
Heisenbergův atomový model

Co je Heisenbergův atomový model?
The Heisenbergův atomový model (1927) zavádí princip neurčitosti na elektronových orbitálech obklopujících atomové jádro. Přední německý fyzik položil základy kvantové mechaniky k odhadu chování subatomárních částic, které tvoří atom.
Princip nejistoty Wernera Heisenberga naznačuje, že není možné s jistotou znát současně polohu a lineární hybnost elektronu. Stejný princip platí pro proměnné čas a energie; to znamená, že pokud máme ponětí o poloze elektronu, neznáme lineární hybnost elektronu a naopak.
Stručně řečeno, není možné současně předpovědět hodnotu obou proměnných. Z výše uvedeného nevyplývá, že žádné z výše uvedených množství nelze přesně znát. Pokud je to samostatně, neexistuje překážka pro získání úrokové hodnoty.
Nejistota však nastává, pokud jde o současné poznání dvou konjugovaných veličin, jako je poloha a lineární hybnost, a času společně s energií..
Tato zásada vzniká na základě přísně teoretického uvažování, jako jediného schůdného vysvětlení, které by poskytlo důvod pro vědecká pozorování.
Charakteristika atomového modelu Heisenberg

V březnu 1927 Heisenberg publikoval svou práci O vnímavém obsahu kinematiky a kvantové teoretické mechaniky, kde jste podrobně popsali princip nejistoty nebo neurčitosti.
Tento princip, zásadní v atomovém modelu navrženém Heisenbergem, je charakterizován následujícím:
- Princip neurčitosti se jeví jako vysvětlení, které doplňuje nové atomové teorie o chování elektronů. I přes použití měřicích přístrojů s vysokou přesností a citlivostí je neurčitost stále přítomna v jakémkoli experimentálním testu.
- Vzhledem k principu nejistoty, pokud máte při analýze dvou souvisejících proměnných přesnou znalost jedné z nich, bude nejistota ohledně hodnoty druhé proměnné stále větší a větší..
- Hybnost a polohu elektronu nebo jiné subatomární částice nelze měřit současně.
- Vztah mezi oběma proměnnými je dán nerovností. Podle Heisenberga je součin variací lineární hybnosti a polohy částice vždy větší než kvocient mezi Plankovou konstantou (6,62606957 (29) × 10) -3. 4 Jules x sekundy) a 4π, jak je podrobně uvedeno v následujícím matematickém výrazu:

Legenda odpovídající tomuto výrazu je následující:
∆p: neurčitost lineárního momentu.
∆x: neurčitost polohy.
h: Plankova konstanta.
π: číslo pi 3.14.
- Vzhledem k výše uvedenému má součin nejistot jako spodní hranici poměr h / 4π, což je konstantní hodnota. Proto pokud má jedna z velikostí tendenci k nule, druhá se musí zvyšovat ve stejném poměru.
- Tento vztah je platný pro všechny páry konjugovaných kanonických veličin. Například: Heisenbergův princip neurčitosti je dokonale použitelný pro dvojici energie a času, jak je podrobně uvedeno níže:
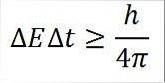
V tomto výrazu:
∆E: neurčitost energie.
:T: neurčitost času.
h: Plankova konstanta.
π: číslo pi 3.14.
- Z tohoto modelu vyplývá, že absolutní kauzální determinismus v konjugovaných kanonických proměnných je nemožný, protože k navázání tohoto vztahu je třeba mít znalosti o počátečních hodnotách studijních proměnných.
- V důsledku toho je Heisenbergův model založen na pravděpodobnostních formulacích kvůli náhodnosti, která existuje mezi proměnnými na subatomárních úrovních..
Experimentální zkoušky
Heisenbergův princip nejistoty se ukazuje jako jediné možné vysvětlení experimentálních testů, které proběhly během prvních tří desetiletí 21. století..
Před tím, než Heisenberg vysvětlil princip nejistoty, v té době platné předpisy naznačovaly, že proměnné lineární hybnost, poloha, moment hybnosti, čas, energie, mimo jiné, pro subatomární částice byly definovány operativně.
To znamenalo, že se s nimi zacházelo, jako by šlo o klasickou fyziku; to znamená, že byla změřena počáteční hodnota a konečná hodnota byla odhadnuta podle předem stanoveného postupu.
To znamenalo definování referenčního systému pro měření, měřicího přístroje a způsobu použití uvedeného přístroje v souladu s vědeckou metodou..
Proto se proměnné popsané subatomárními částicemi musely chovat deterministicky. To znamená, že jeho chování muselo být předvídáno přesně a přesně..
Avšak pokaždé, když byla provedena zkouška tohoto druhu, nebylo možné získat teoreticky odhadovanou hodnotu v měření..
Měření byla zkreslena kvůli přirozeným podmínkám experimentu a získaný výsledek nebyl užitečný pro obohacení atomové teorie.
Příklad
Například: jedná-li se o měření rychlosti a polohy elektronu, je třeba při pokusu uvažovat o srážce fotonu světla s elektronem.
Tato kolize vyvolává kolísání rychlosti a vnitřní polohy elektronu, s nimiž se předmět měření mění experimentálními podmínkami..
Výzkumník proto podporuje výskyt nevyhnutelné experimentální chyby navzdory přesnosti a přesnosti použitých nástrojů..
Kvantová mechanika jiná než klasická mechanika
Kromě výše uvedeného Heisenbergův princip neurčitosti uvádí, že podle definice funguje kvantová mechanika odlišně od klasické mechaniky.
V důsledku toho se předpokládá, že přesná znalost měření na subatomární úrovni je omezena jemnou čarou, která odděluje klasickou a kvantovou mechaniku..
Omezení Heisenbergova modelu
Navzdory vysvětlení neurčitosti subatomárních částic a stanovení rozdílů mezi klasickou a kvantovou mechanikou Heisenbergův atomový model nestanoví jedinou rovnici pro vysvětlení náhodnosti tohoto typu jevů..
Skutečnost, že je vztah vytvořen nerovností, navíc znamená, že rozsah možností pro součin dvou konjugovaných kanonických proměnných je neurčitý. V důsledku toho je nejistota inherentní subatomárním procesům významná..
Články zájmu
Schrödingerův atomový model.
Atomový model de Broglie.
Chadwickův atomový model.
Perrinův atomový model.
Thomsonův atomový model.
Daltonův atomový model.
Atomový model Dirac Jordan.
Atomový model Demokrita.
Atomový model Leucippus.
Bohrův atomový model.
Sommerfeldův atomový model.
Aktuální atomový model.
Reference
- Beyler, R. (1998). Werner Heisenberg. Encyklopedie Britannica, Inc. Obnoveno z: britannica.com
- Heisenbergův princip nejistoty (s.f.). Obnoveno z: hiru.eus
- García, J. (2012). Heisenbergův princip nejistoty. Obnoveno z: hiberus.com
- Atomové modely (s.f.). Národní autonomní univerzita v Mexiku. Mexico DF, Mexiko. Obnoveno z: asesorias.cuautitlan2.unam.mx
- Werner Heisenberg (s.f.). Obnoveno z: the-history-of-the-atom.wikispaces.com
- Wikipedia, The Free Encyclopedia (2018). Plankova konstanta. Obnoveno z: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2018). Heisenbergův neurčitostní vztah. Obnoveno z: es.wikipedia.org



Zatím žádné komentáře