
Thomsonova charakteristika atomového modelu, postuláty, subatomární částice

The Thomsonův atomový model Vytvořil jej slavný anglický fyzik J. J. Thomson, který objevil elektron. Za tento objev a za práci na elektrickém vedení v plynech mu byla v roce 1906 udělena Nobelova cena za fyziku.
Z jeho práce s katodovými paprsky vyšlo najevo, že atom nebyl nedělitelnou entitou, jak předpokládal Dalton v předchozím modelu, ale že obsahoval dobře definovanou vnitřní strukturu..
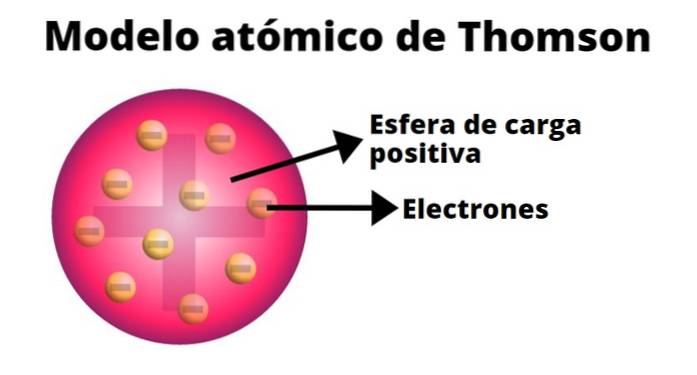
Thomson vytvořil model atomu na základě výsledků svých experimentů s katodovými paprsky. V něm uvedl, že elektricky neutrální atom byl tvořen kladnými a zápornými náboji stejné velikosti..
Rejstřík článků
- 1 Jak se nazýval Thomsonův atomový model a proč?
- 2 Charakteristika a postuláty Thomsonova modelu
- 2.1 Katodové paprsky
- 3 Subatomové částice z Thomsonova atomového modelu
- 3.1 Crookesova trubice
- 3.2 Nabité částice v jednotných elektrických a magnetických polích
- 4 Thomsonův experiment
- 4.1 Vztah náboj-hmotnost elektronu
- 5 Rozdíly modelů Thomson a Dalton
- 6 Selhání a omezení modelu
- 7 Články zájmu
- 8 Reference
Jak se nazýval atomový model Thomson a proč?
Podle Thomsona byl kladný náboj distribuován po celém atomu a záporné náboje byly do něj vloženy jako rozinky v pudinku. Z tohoto srovnání vzešel termín „pudink s rozinkami“, jak byl model neformálně znám..

Ačkoli Thomsonova myšlenka dnes vypadá docela primitivně, na svou dobu představovala nový přínos. Během krátkého života modelu (od roku 1904 do roku 1910) měl podporu mnoha vědců, ačkoli mnoho dalších to považovalo za kacířství.
Nakonec se v roce 1910 objevily nové důkazy o atomové struktuře a Thomsonův model rychle padl na stranu. Stalo se tak, jakmile Rutherford zveřejnil výsledky svých rozptylových experimentů, které odhalily existenci atomového jádra..
Thomsonův model však jako první postuloval existenci subatomárních částic a jeho výsledky byly výsledkem jemného a důkladného experimentování. Tímto způsobem vytvořil precedens pro všechny objevy, které následovaly..
Charakteristika a postuláty Thomsonova modelu
Thomson dospěl ke svému atomovému modelu na základě několika pozorování. První bylo, že rentgenové paprsky nově objevené Roentgenem byly schopné ionizovat molekuly vzduchu. Do té doby bylo jediným způsobem ionizace chemická separace iontů v roztoku..
Anglickému fyzikovi se však pomocí rentgenových paprsků podařilo úspěšně ionizovat i monatomické plyny, jako je helium. To ho vedlo k přesvědčení, že náboj uvnitř atomu lze oddělit, a že tedy není nedělitelný. Také si všiml, že katodové paprsky mohou být vychýleny elektrickým a magnetickým polem.

Thomson tedy vymyslel model, který správně vysvětlil skutečnost, že atom je elektricky neutrální a že katodové paprsky jsou složeny ze záporně nabitých částic..
Pomocí experimentálních důkazů Thomson charakterizoval atom takto:
-Atom je elektricky neutrální pevná koule s poloměrem přibližně 10-10 m.
-Kladný náboj je distribuován víceméně rovnoměrně po kouli.
-Atom obsahuje záporně nabité „krvinky“, které zajišťují jeho neutralitu..
-Tyto krvinky jsou stejné pro veškerou hmotu.
-Když je atom v rovnováze, existuje n krvinky pravidelně uspořádané v prstencích v oblasti pozitivního náboje.
-Hmotnost atomu je rovnoměrně rozložena.
Katodové paprsky

Thomson provedl své experimenty pomocí katodových paprsků objevených v roce 1859. Katodové paprsky jsou svazky záporně nabitých částic. K jejich výrobě se používají vakuové skleněné trubice, ve kterých jsou umístěny dvě elektrody, tzv katoda Y anoda.
Poté prochází elektrický proud, který ohřívá katodu, která tímto způsobem vydává neviditelné záření, které je směrováno přímo na opačnou elektrodu..
Pro detekci záření, které není ničím jiným než katodovými paprsky, je stěna trubice za anodou pokryta fluorescenčním materiálem. Když tam záření dosáhne, vydává stěna trubice intenzivní zářivost.
Pokud se katodovým paprskům dostane do cesty pevný předmět, vrhá stín na stěnu trubice. To naznačuje, že paprsky se pohybují po přímce a také, že je lze snadno zablokovat..
Povaha katodových paprsků byla široce diskutována, protože jejich povaha nebyla známa. Někteří si mysleli, že jsou to vlny elektromagnetického typu, zatímco jiní tvrdili, že jsou to částice..
Subatomární částice Thomsonův atomový model
Thomsonův atomový model je, jak jsme řekli, první, kdo předpokládá existenci subatomárních částic. Thomsonovy krvinky nejsou nic jiného než elektrony, základní záporně nabité částice atomu..
V současné době víme, že další dvě základní částice jsou kladně nabitý proton a nenabitý neutron..
Ty však nebyly objeveny v době, kdy Thomson vyvinul svůj model. Kladný náboj v atomu byl v něm distribuován, neuvažoval o žádné částice nesoucí uvedený náboj a v tuto chvíli neexistoval žádný důkaz o jeho existenci.
Z tohoto důvodu měl jeho model prchavou existenci, protože v průběhu několika let připravily Rutherfordovy rozptylové experimenty cestu k objevu protonu. A pokud jde o neutron, sám Rutherford navrhl jeho existenci několik let před jeho konečným objevením..
Crookesova trubice
Sir William Crookes (1832-1919) navrhl trubku, která nese jeho jméno kolem roku 1870, s úmyslem pečlivě studovat povahu katodových paprsků. Přidal elektrická pole a magnetická pole a pozoroval, že paprsky jsou těmito paprsky vychýleny.
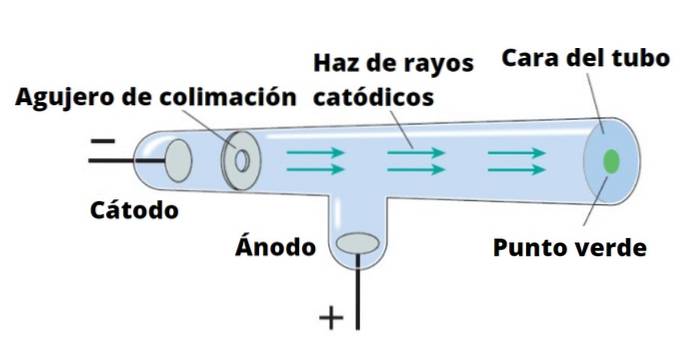
Crookes a další vědci, včetně Thomsona, tak zjistili, že:
- Uvnitř katodové trubice byl generován elektrický proud
- Paprsky byly odkloněny přítomností magnetických polí, stejně jako záporně nabité částice..
- Jakýkoli kov použitý k výrobě katody sloužil stejně dobře k produkci katodových paprsků a jejich chování bylo nezávislé na materiálu..
Tato pozorování podpořila diskusi o původu katodových paprsků. Ti, kteří tvrdili, že jsou to vlny, vycházeli ze skutečnosti, že katodové paprsky mohou cestovat přímočaře. Kromě toho tato hypotéza velmi dobře vysvětlila stín, který vložený pevný předmět vrhl na stěnu trubice a za určitých okolností bylo známo, že vlny mohou způsobit fluorescenci.
Ale na druhou stranu nebylo pochopeno, jak je možné, že magnetické pole odkloní katodové paprsky. To by se dalo vysvětlit, pouze kdyby uvedené paprsky byly považovány za částice, což je hypotéza, kterou Thomson sdílel..
Nabité částice v jednotných elektrických a magnetických polích
Nabitá částice s nábojem q zažívá sílu Fe uprostřed rovnoměrného elektrického pole E o velikosti:
Fe = qE
Když nabitá částice kolmo prochází rovnoměrným elektrickým polem, jako je pole vytvářené mezi dvěma deskami s opačnými náboji, dochází k vychýlení a následně k zrychlení:
qE = ma
a = qE / m
Na druhou stranu, pokud se nabitá částice pohybuje rychlostí o velikosti v, uprostřed rovnoměrného magnetického pole o velikosti B, má magnetická síla Fm, kterou zažívá, následující intenzitu:
Fm = qvB
Pokud jsou vektory rychlosti a magnetického pole kolmé. Když nabitá částice narazí na homogenní magnetické pole kolmo, také prochází průhybem a její pohyb je rovnoměrný kruhový.
Dostředivé zrychlení přiC v tomto případě je to:
qvB = maC
Dostředivé zrychlení zase souvisí s rychlostí částice v a poloměrem R kruhové dráhy:
naC = vdva/ R.
Proto:
qvB = mvdva/ R.
Poloměr kruhové dráhy lze vypočítat takto:
R = mv / qB
Tyto rovnice budou použity později k opětovnému vytvoření způsobu, jakým Thomson odvodil vztah náboje a hmotnosti elektronu..
Thomsonův experiment
Thomson prošel paprskem katodových paprsků, paprskem elektronů, i když to ještě nevěděl, jednotnými elektrickými poli. Tato pole jsou vytvářena mezi dvěma nabitými vodivými deskami oddělenými malou vzdáleností.
Rovněž prošel katodovými paprsky rovnoměrným magnetickým polem a sledoval účinek, který to mělo na paprsek. V jednom i v druhém poli došlo k vychýlení paprsků, což Thomsona přimělo správně si myslet, že paprsek byl složen z nabitých částic.
Aby to ověřil, provedl Thomson několik strategií s katodovými paprsky:
- Změnil elektrické a magnetické pole, dokud síly nevymizely. Tímto způsobem prošly katodové paprsky, aniž by došlo k vychýlení. Pomocí rovnice elektrických a magnetických sil byl Thomson schopen určit rychlost částic v paprsku.
- Zrušilo to intenzitu elektrického pole, takže částice následovaly kruhovou cestu uprostřed magnetického pole.
- Zkombinoval výsledky kroků 1 a 2, aby určil vztah náboj-hmota „krvinek“..
Poměr náboje a hmotnosti elektronu
Thomson určil, že poměr náboje a hmotnosti částic, které tvoří paprsek katodového paprsku, má následující hodnotu:
q / m = 1,758820 x 10 11 C.kg-1.
Kde q představuje náboj „tělíska“, kterým je ve skutečnosti elektron a m je jeho hmotnost. Thomson postupoval podle postupu popsaného v předchozí části, který zde postupně vytváříme, pomocí rovnic, které použil.

Krok 1
Vyrovnejte elektrickou a magnetickou sílu procházející paprskem kolmým elektrickým a magnetickým polem:
qvB = qE
Krok 2
Určete rychlost získanou částicemi v paprsku, když procházejí přímo bez vychýlení:
v = E / B
Krok 3
Zrušte elektrické pole a ponechte pouze magnetické pole (nyní je zde průhyb):
R = mv / qB
Výsledkem v = E / B je:
R = mE / qBdva
Poloměr oběžné dráhy lze měřit, proto:
q / m = v / RB
Dobře:
q / m = E / RBdva
Další kroky
Další věcí, kterou Thomson udělal, bylo změřit poměr q / m pomocí katod vyrobených z různých materiálů. Jak již bylo uvedeno, všechny kovy vyzařují katodové paprsky se stejnými vlastnostmi..
Poté Thomson porovnal jeho hodnoty s hodnotami poměru q / m vodíkového iontu získaného elektrolýzou a jehož hodnota je přibližně 1 x 108 C / kg. Poměr náboje a hmotnosti elektronu je přibližně 1750krát větší než u vodíkového iontu.
Proto měly katodové paprsky mnohem větší náboj, nebo snad mnohem menší hmotnost než vodíkový iont. Vodíkový iont je jednoduše proton, jehož existence se stala známou dlouho po Rutherfordových rozptylových experimentech..
Dnes je známo, že proton je téměř 1800krát hmotnější než elektron a má náboj stejné velikosti a opačného znaménka jako elektron..
Dalším důležitým detailem je, že Thomsonovy experimenty přímo neurčily elektrický náboj elektronu, ani hodnotu jeho hmotnosti zvlášť. Tyto hodnoty byly určeny Millikanovými experimenty, které začaly v roce 1906..
Thomson a Dalton modelové rozdíly
Zásadním rozdílem těchto dvou modelů je to, že si Dalton myslel, že atom je koule. Na rozdíl od Thomsona nenavrhoval existenci kladných ani záporných nábojů. Pro Daltona vypadal atom takto:

Jak jsme viděli dříve, Thomson si myslel, že atom je dělitelný a jehož strukturu tvoří pozitivní koule a elektrony kolem.
Chyby modelu a omezení
V té době se Thomsonovu atomovému modelu podařilo velmi dobře vysvětlit chemické chování látek. Správně také vysvětlil jevy, ke kterým došlo v katodové trubici.
Ve skutečnosti však Thomson své částice ani nenazval „elektrony“, ačkoli tento termín již dříve vytvořil George Johnstone Stoney. Thomson je jednoduše nazval „krvinky“..
Ačkoli Thomson využil všechny znalosti, které měl v té době k dispozici, jeho model má několik důležitých omezení, která se projevila velmi brzy:
-Kladný náboj není distribuován po celém atomu. Rutherfordovy rozptylové experimenty ukázaly, že kladný náboj atomu je nutně omezen na malou oblast atomu, která se později stala známou jako atomové jádro..
-Elektrony mají specifické rozdělení v každém atomu. Elektrony nejsou rovnoměrně rozloženy, jako rozinky ve slavném pudingu, ale mají uspořádání na orbitálech, které odhalily pozdější modely.
Právě uspořádání elektronů v atomu umožňuje uspořádat prvky podle jejich charakteristik a vlastností v periodické tabulce. Jednalo se o důležité omezení Thomsonova modelu, které nedokázalo vysvětlit, jak je možné takto objednat prvky..
-Atomové jádro je to, které obsahuje většinu hmoty. Thomsonův model předpokládal, že hmotnost atomu byla v něm rovnoměrně rozložena. Ale dnes víme, že hmotnost atomu je prakticky koncentrována v protonech a neutronech jádra..
Je také důležité si uvědomit, že tento model atomu neumožňoval odvodit typ pohybu, který elektrony uvnitř atomu měly..
Články zájmu
Schrödingerův atomový model.
Atomový model de Broglie.
Chadwickův atomový model.
Heisenbergův atomový model.
Perrinův atomový model.
Daltonův atomový model.
Atomový model Dirac Jordan.
Atomový model Demokrita.
Atomový model Leucippus.
Bohrův atomový model.
Sommerfeldův atomový model.
Aktuální atomový model.
Reference
- Andriessen, M. 2001. Kurz HSC. Fyzika 2. Jacaranda HSC Science.
- Arfken, G. 1984. Univerzitní fyzika. Akademický tisk.
- Knight, R. 2017. Fyzika pro vědce a inženýrství: strategický přístup. Pearson.
- Rex, A. 2011. Fyzikální základy. Pearson.
- Wikipedia. Thomsonův atomový model. Obnoveno z: es.wikipedia.org.



Zatím žádné komentáře