
Struktura, vlastnosti a použití dusičnanu vápenatého (Ca (NO3) 2)

The dusičnan vápenatý je terciární anorganická sůl, jejíž chemický vzorec je Ca (NO3)dva. Z jeho vzorce je známo, že jeho pevná látka je složena z iontů Ca.dva+ a žádná3- v poměru 1: 2. Jedná se tedy o sloučeninu čistě iontové povahy..
Jednou z jeho vlastností je oxidační charakter díky dusičnanovému aniontu. Není hořlavý, to znamená, že nehoří při vysokých teplotách. Protože je nehořlavý, představuje bezpečnou pevnou látku pro manipulaci bez velké péče; Může však urychlit vznícení hořlavých materiálů.

Jeho vzhled se skládá z granulované pevné látky, která má bílou nebo světle šedou barvu (horní obrázek). Může to být bezvodý nebo tetrahydrát, Ca (NO3)dva4HdvaO. Je velmi rozpustný ve vodě, methanolu a acetonu.
Dusičnan vápenatý byl široce používán jako hnojivo, protože se snadno pohybuje ve vlhké půdě a je rychle absorbován kořeny rostlin. Poskytuje dva důležité prvky pro výživu a růst rostlin: dusík a vápník.
Dusík je jedním ze tří základních prvků pro vývoj rostlin (N, P a K), je nezbytný při syntéze bílkovin. Mezitím je vápník nezbytný k udržení struktury buněčné stěny rostlin. Z tohoto důvodu Ca (NO3)dva hodně jde do zahrad.
Na druhou stranu má tato sůl toxické účinky, zejména přímým kontaktem s pokožkou a očima a vdechováním prachu. Kromě toho může být rozložen zahřátím.
Rejstřík článků
- 1 Struktura dusičnanu vápenatého
- 2 Fyzikální a chemické vlastnosti
- 2.1 Chemické názvy
- 2.2 Molekulární vzorec
- 2.3 Molekulová hmotnost
- 2.4 Fyzický vzhled
- 2.5 Bod varu
- 2.6 Teplota tání
- 2.7 Rozpustnost ve vodě
- 2.8 Rozpustnost v organických rozpouštědlech
- 2,9 Kyselost (pKa)
- 2.10 Hustota
- 2.11 Rozklad
- 2.12 Reaktivní profil
- 3 použití
- 3.1 Zemědělství
- 3.2 Beton
- 3.3 Čištění odpadních vod nebo odpadních vod
- 3.4 Výroba studených obkladů
- 3.5 Latexová koagulace
- 3.6 Přenos a skladování tepla
- 4 Formy použití
- 5 Reference
Struktura dusičnanu vápenatého
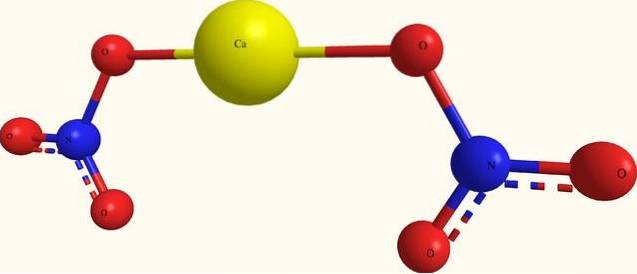
Horní obrázek ukazuje strukturu Ca (NO3)dva v modelu koulí a tyčí. Zde však existuje chyba: předpokládá se existence kovalentních vazeb Ca-O, což je v rozporu s jejich iontovým charakterem. Abychom to vyjasnili, interakce jsou ve skutečnosti elektrostatického typu.
Kation Cadva+ obklopuje se dvěma NO anionty3- podle jeho rozměrů na skle. Proto v krystalické struktuře převládá dusík ve formě dusičnanů..
Iony jsou seskupeny takovým způsobem, že vytvářejí konfiguraci, jejíž minimální výraz je jednotková buňka; který je pro bezvodou sůl krychlový. To znamená, že z krychlí obsahujících poměr 1: 2 pro tyto ionty je reprodukován celý krystal.
Na druhou stranu, tetrahydrátová sůl, Ca (NO3)dva4HdvaNebo má čtyři molekuly vody pro každou sadu NO3- ACdva+ NE3-. To modifikuje krystalovou strukturu a deformuje ji do monoklinické jednotkové buňky..
Očekává se proto, že se krystaly jak bezvodých, tak tetrahydrátových solí budou lišit; rozdíly, které lze určit v jejich fyzikálních vlastnostech, například teploty tání.
Fyzikální a chemické vlastnosti
Chemické názvy
-Dusičnan vápenatý
-Dinitrát vápenatý
-Nitrokalcit
-Norský ledek a limesaltpetro.
Molekulární vzorec
Chrlič3)dva nebo CaNdvaNEBO6
Molekulární váha
Bezvodý 164,088 g / mol a tetrahydrát 236,15 g / mol. Všimněte si vlivu vody na molekulovou hmotnost a při její vážení ji nelze zanedbávat..
Fyzický vzhled
Bílá nebo světle šedá pevná látka nebo granule. Kubické bílé krystaly nebo rozplývavé granule; to znamená, že absorbují vlhkost do té míry, že se rozpustí v důsledku své vysoké rozpustnosti.
Bod varu
Bezvodá forma se rozkládá při zahřátí na teplotu, která znemožňuje stanovení bodu varu; zatímco tetrahydrátová forma soli má teplotu varu 132 ° C (270 ° F, 405 K).
Bod tání
-Bezvodá forma: 561 ° C až 760 mmHg (1042 ° F, 834 K).
-Forma tetrahydrátu: 42,7 ° C (109 ° F, 316 K).
To ukazuje, jak molekuly vody interferují s elektrostatickými interakcemi mezi Cadva+ a žádná3- uvnitř krystalů; a následně se pevná látka taje při mnohem nižší teplotě.
Rozpustnost ve vodě
-Bezvodá forma: 1212 g / l při 20 ° C.
-Forma tetrahydrátu: 1290 g / l při 20 ° C.
Voda v krystalech těžko zvyšuje rozpustnost soli.
Rozpustnost v organických rozpouštědlech
-V ethanolu 51,42 g / 100 g při 20 ° C.
-V methanolu, 134 g / 100 g při 10 ° C.
-V acetonu, 168 g / 100 g při 20 ° C.
Kyselost (pKa)
6.0
Hustota
2,5 g / cm3 při 25 ° C (tetrahydrát).
Rozklad
Když se dusičnan vápenatý zahřeje na žárovku, rozloží se na oxid vápenatý, oxid dusíku a kyslík..
Reaktivní profil
Je to silně oxidační činidlo, ale není hořlavé. Urychluje vznícení hořlavých materiálů. Rozdělení dusičnanu vápenatého na jemné částice usnadňuje jeho výbuch, když je sloučenina vystavena dlouhodobému ohni.
Směsi s alkylestery se stávají výbušnými původními estery alkylnitrátů. Kombinace dusičnanu vápenatého s fosforem, chloridem cínatým nebo jiným redukčním činidlem může reagovat výbušně.
Aplikace
zemědělství
Používá se v plodinách jako zdroj dusíku a vápníku. Dusičnan vápenatý je velmi rozpustný ve vodě a snadno absorbován kořeny rostlin. Kromě toho nekyslí půdy, protože jeho ionty nelze významně hydrolyzovat..
Je třeba se vyhnout míchání s hnojivy obsahujícími fosfor nebo síran, aby se zabránilo tvorbě nerozpustných solí. Vzhledem ke své hygroskopičnosti by měl být skladován v suchém a chladném prostředí.
Jeho použití má výhodu oproti použití dusičnanu amonného jako hnojiva. Ačkoli tato poslední sloučenina přispívá k rostlinám dusíkem, interferuje s absorpcí vápníku, což by mohlo vést k nedostatku vápníku v rostlinách..
Vápník přispívá k udržování struktury buněčné stěny rostlin. V přítomnosti nedostatku vápníku vykazují rostoucí tkáně rostlin, jako jsou kořenové špičky, mladé listy a špičky výhonků, často zkreslený růst..
Snížený amoniak
Dusičnan vápenatý snižuje akumulaci těkavých mastných kyselin a fenolových sloučenin, fytotoxických, které se hromadí v důsledku rozkladu zbytků sójových plodin.
Kromě toho existuje tendence dusičnanu vápenatého snižovat koncentraci amonia v půdě, což zvyšuje kapacitu pufru vodíku..
Beton
Dusičnan vápenatý se používá ke snížení doby tuhnutí betonu. To se vyrábí generováním hydroxidu vápenatého, snad prostřednictvím reakce s dvojitým vytěsněním..
Dusičnan vápenatý navíc indukuje vznik sloučeniny hydroxidu železa, jehož ochranný účinek na beton snižuje jeho korozi. To znamená, že přítomné železo může reagovat se základními složkami betonu, jako je samotný hydroxid vápenatý..
Dusičnan vápenatý snižuje dobu tuhnutí a také odolnost betonu, ke kterému byl přidán vulkanický popel. Ke studiu účinku přidání dusičnanu vápenatého do betonu byly použity zvyšující se koncentrace dusičnanu vápenatého, mezi 2% a 10%..
Bylo pozorováno větší zkrácení doby tuhnutí a zvýšení pevnosti betonu, protože koncentrace dusičnanu vápenatého vzrostla až o 10%.
Čištění odpadních vod nebo odpadních vod
Dusičnan vápenatý se používá ke snížení zápachu z odpadních vod snížením tvorby sirovodíku. Kromě toho se spotřebovává organická hmota, která vytváří anaerobní podmínky, což ztěžuje přežití mnoha biologických druhů..
Výroba studených obkladů
Dusičnan vápenatý tetrahydrát je endotermická sloučenina, to znamená, že má schopnost absorbovat teplo z okolního prostředí. To způsobí ochlazení těl, která přicházejí do styku s nádobami, které je obsahují..
Obklady zvyšují jejich teplotu a k jejich regeneraci stačí je umístit do mrazničky
Latexová koagulace
Dusičnan vápenatý se používá ve fázi koagulace latexu. Je součástí ponořovacího roztoku a při kontaktu s roztokem obsahujícím latex narušuje jeho stabilizaci a způsobuje jeho koagulaci..
Přenos a skladování tepla
Binární směs roztavených dusičnanových solí, včetně vápníku s jinými dusičnany, se používá místo tepelného oleje v solárních elektrárnách pro přenos a skladování tepla.
Formy aplikace
-Dusičnan vápenatý se aplikuje ve směsi s půdou v koncentraci 1,59 kg na 30,48 mdva, s dostatečným zaléváním. Dusičnan vápenatý je solubilizován ve vodě, což umožňuje jeho absorpci kořeny rostliny. V hydroponických plodinách se rozpouští v rostoucí vodě.
-Dusičnan vápenatý se také používá ve formě spreje ke stříkání listů a květů, což je účinná léčba při prevenci hniloby rajčatového květu, korkové skvrny a hořké jámy jablka..
-Do směsi tvořící beton se přidá určité množství dusičnanu vápenatého (cement, písek, kameny a voda) a stanoví se účinek, který má jeho přidání na specifické vlastnosti betonu; jako je nastavení rychlosti a síly.
-Dusičnan vápenatý se přidává ve vhodné koncentraci ke snížení zápachu z odpadních vod nebo odpadních vod na úroveň, která je pro lidi tolerovatelná..
Reference
- Bonnie L. Grant. (2019). Hnojivo na bázi dusičnanu vápenatého - co dusičnan vápenatý dělá pro rostliny. Obnoveno z: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. a Vyn, T.J. (1990). Použití dusičnanu vápenatého ke snížení akumulace fytotoxinů během rozkladu zbytků firem. Canadian Journal of Soil Science 70 (4): 723-726.
- Ogunbode, E. B. a Hassan, I.O. (2011). Vliv přidání dusičnanu vápenatého na selektivní vlastnosti betonu obsahujícího sopečný popel. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Dusičnan vápenatý. Obnoveno z: en.wikipedia.org
- Shiqi Dong a plk. (2018). Inhibice koroze oceli dusičnanem vápenatým v kapalném prostředí obohaceném halogenidem. npj Svazek degradace materiálů 2, číslo článku: 32.
- Emaginationz Technologies. (2019). Specifikace dusičnanu vápenatého. Obnoveno z: direct2farmer.com
- PubChem. (2019). Dusičnan vápenatý. Obnoveno z: pubchem.ncbi.nlm.nih.gov



Zatím žádné komentáře