
Struktura, vlastnosti a použití dusitanu draselného (KNO2)

The dusitan draselný je anorganická sůl, jejíž chemický vzorec je KNOdva, který chemicky a farmakologicky souvisí s dusičnanem draselným, KNO3. Jeho fyzický vzhled se skládá z nažloutlých bílých krystalů, vysoce hygroskopických a proto křehkých; to znamená, že se rychle rozpouštějí ve vlhkém prostředí.
Jeho vzorec ukazuje, že podíl iontů K.+ a žádnádva- je 1: 1 a jsou drženy pohromadě elektrostatickými silami nebo iontovými vazbami. Zdá se, že u jeho krystalů nebyly nalezeny žádné čisté přírodní zdroje, ačkoli dusitanové anionty lze nalézt v půdách, hnojivech, rostlinách a zvířatech..

Obrázek výše ukazuje, jak vypadají krystaly KNOdva, s výraznými žlutými tóny. Pokud tyto krystaly zůstanou ve styku se vzduchem, budou absorbovat vlhkost, dokud se nestanou vodným roztokem; řešení, které vyvolalo polemiku ohledně toho, zda je jeho použití pro lékařské účely prospěšné či nikoli.
Na druhé straně se jeho krystaly ve velmi malém množství (200 ppm) používají k zasolení masa a zaručení jeho konzervace proti působení bakterií. Stejně tak KNOdva vylepšuje barvu masa a dodává mu více načervenalé barvy; podléhá však několika omezením, aby se zabránilo toxickým účinkům této soli v těle.
Rejstřík článků
- 1 Struktura dusitanu draselného
- 2 Vlastnosti
- 2.1 Molekulová hmotnost
- 2.2 Hustota
- 2.3 Bod tání
- 2.4 Bod varu
- 2.5 Rozpustnost ve vodě
- 2.6 Deliquescence
- 2.7 Rozpustnost v jiných rozpouštědlech
- 2,8 pH
- 3 Názvosloví
- 4 Získání
- 5 použití
- 5.1 Aditivum a činidlo
- 5.2 Protilátka
- 5.3 Lékaři
- 6 Reference
Struktura dusitanu draselného
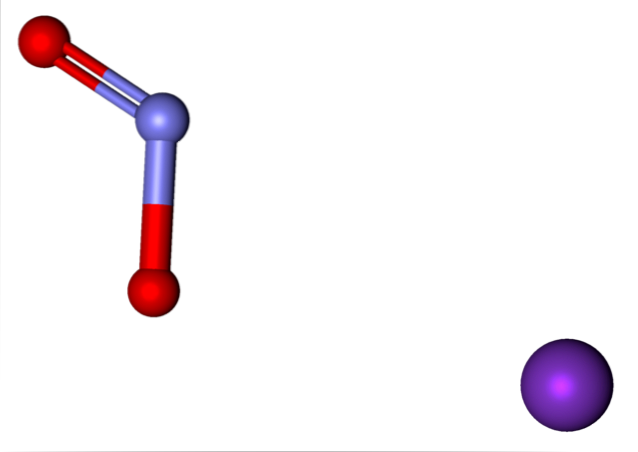
Ionty přítomné v dusitanu draselném jsou uvedeny výše. K kation+ odpovídá fialové sféře, zatímco NO aniondva- je reprezentována modravou a červenou koulí.
Anion NEdva- zobrazeno s jednou dvojnou a jednou jednoduchou vazbou [O = N-O]-; ale ve skutečnosti jsou obě vazby rovnocenným produktem rezonance záporného náboje mezi nimi.
Ionty K.+ a žádnádva- přitahují se navzájem ve vesmíru, dokud neuspořádají strukturální vzorec s nejmenší energií; to je, kde jsou odrazy mezi stejnými poplatky minimální. A tak vytvářejí krystaly KNOdva, jejichž jednotková buňka je citlivá na změny teploty a které fázové přechody.
Například při nízkých teplotách (méně než 25 ° C) krystaly KNOdva přijmout monoklinický systém (fáze I). Když teplota překročí 25 ° C, dojde k fázovému přechodu z monoklinického do romboedrického (fáze II). Nakonec nad 40 ° C krystaly KNOdva změna na kubický (fáze III).
Stejně tak KNOdva může vykazovat další krystalické fáze (fáze IV, V a VI) za vysokého tlaku. Díky tomu ionty K.+ a žádnádva- ve svých čistých krystalech se pohybují a objednávají různými způsoby.
Vlastnosti
Molekulová hmotnost
85,1038 g / mol.
Hustota
1,9150 g / ml.
Bod tání
440,02 ° C (ale začíná se rozkládat od 350 ° C a vydává toxické výpary).
Bod varu
537 ° C (exploduje).
Rozpustnost ve vodě
312 g / 100 g vody při 25 ° C.
Deliquescence
Jeho rozpustnost ve vodě je taková, že je hygroskopická; natolik, že vykazuje rozmělnění a absorbuje dostatek vlhkosti k rozpuštění. Tato afinita k vodě může být způsobena energetickou stabilitou, kterou ionty K. získávají+ při hydrataci, stejně jako nízká mřížková entalpie pro krystaly KNOdva.
Krystaly mohou absorbovat vodu, aniž by se rozpustily, aby se z nich stal hydrát, KNOdvaHdvaO. V hydrátu se nachází molekula vody doprovázející ionty, která modifikuje krystalickou strukturu.
Tento hydrát (nebo několik z nich) může být vytvořen při teplotě nižší než -9 ° C; při vyšších teplotách voda rozpouští a hydratuje ionty a deformuje krystal.
Rozpustnost v jiných rozpouštědlech
Mírně rozpustný v horkých alkoholech a velmi snadno rozpustný v amoniaku.
pH
6-9. Jeho vodné roztoky jsou proto zásadité, protože anion NOdva- lze hydrolyzovat.
Nomenklatura
KNOdva může být také pojmenován jinými způsoby. „Dusitan draselný“ odpovídá názvu této soli podle základní nomenklatury; „dusitan draselný“ podle systematické nomenklatury, ve které je zvýrazněna jediná valence draslíku +1; a dioxonitrát draselný (III) podle systematické nomenklatury.
Název „dioxonitrát draselný (III)“ zdůrazňuje +3 valenci atomu dusíku. I když se jedná o nejvíce doporučovaný název IUPAC pro KNOdva, „Dusitan draselný“ je i nadále nejpohodlnější a nejsnáze zapamatovatelný.
Získávání
Nejpřímějším způsobem, jak jej syntetizovat, ale s nižším výtěžkem, je tepelný rozklad dusičnanu draselného nebo ledku při teplotě 400 ° C nebo více:
2KNO3 => KNOdva + NEBOdva
Část KNOdva Nakonec se rozloží teplem, kromě dalších vytvářených produktů.
Další metodou jeho přípravy nebo syntézy s vyšším výtěžkem je redukce KNO3 v přítomnosti olova, mědi nebo zinku. Rovnice pro tuto reakci je následující:
KNO3 + Pb => KNOdva + PbO
Dusičnan draselný a olovo se smíchají stechiometricky na železné pánvi, kde se za stálého míchání a zahřívání půl hodiny tají. Oxid olovnatý (II) má žlutou barvu a výsledná hmota se za horka rozemlí na prášek a zpracuje vroucí vodou. Poté se horká směs filtruje.
Horký filtrát je probubláván oxidem uhličitým po dobu pěti minut, což vysráží uhličitan olovnatý, PbCO3, nerozpustný. Tímto způsobem se olovo oddělí od filtrátu. K filtrátu se přidává zředěná kyselina dusičná, dokud není pH neutrální, nechá se vychladnout a nakonec se voda odpaří, aby se vytvořily krystaly KNO.dva.
Aplikace
Aditivum a činidlo
Dusitan draselný se používá jako přísada k ošetření červeného masa, přičemž si během skladování udržuje delší chuť a barvu, přičemž zpomaluje působení bakterií a určitých toxinů, jako je botulinum. Proto vykazuje antibakteriální účinek.
KNOdva oxiduje na NO, který reaguje s myoglobinem v mase a následně mění svoji přirozenou červenou barvu. Později, když se maso vaří, získává svou charakteristickou silně růžovou barvu.
Za podmínek bez uvedení KNOdva reaguje s masnými bílkovinami za vzniku nitrosaminů, které se mohou stát karcinogenními.
Na druhé straně KNOdva (i když nejlépe NaNOdva) je analytické činidlo, které lze použít při syntéze azobarviv (reakce kyseliny dusité s aromatickými aminy) a při analýze aminokyselin.
Protijed
I když to má své negativní účinky, KNOdva působí jako protijed u pacientů otrávených kyanidy a sirovodíkem. Jeho mechanismus spočívá v oxidaci Fe centerdva+ víře3+ ze skupin máme hemoglobiny, produkující methemoglobin, který pak reaguje s anionty CN- a HS-.
Lékaři
V žaludeční šťávě žaludku anion NOdva- redukuje se na NO, o kterém je známo, že má vazodilatační účinek, což zvyšuje průtok krve. V jiných oblastech těla, kde pH není dostatečně kyselé, jsou některé enzymy, jako je xanthinoxidoreduktáza, odpovědné za snížení NOdva-.
Bylo použito KNOdva k léčbě onemocnění a onemocnění, jako je angina pectoris a epilepsie (s velmi negativními vedlejšími účinky).
Reference
- Wikipedia. (2019). Dusitan draselný. Obnoveno z: en.wikipedia.org
- PrebChem. (2016). Příprava dusitanu draselného. Obnoveno z: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Anorganický dusičnan a dusitany a kontrola krevního tlaku, Kardiovaskulární výzkum, svazek 89, vydání 3, 15. února 2011, strany 492-498, doi.org/10.1093/cvr/cvq309
- PubChem. (2019). Dusitan draselný. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Chemická formulace. (2018). Dusitan draselný. Obnoveno z: formulacionquimica.com
- Národní centrum pro rozvoj translačních věd. (2011). Dusitan draselný. Obnoveno z: drugs.ncats.io
- Richard J. Epley, Paul B. Addis a Joseph J. Warthesen. (1992). Dusitany v mase. University of Minnesota.
- N. R. Rao, B. Prakash a M. Natarajan. (1975). Transformace krystalové struktury v anorganických dusitanech, dusičnanech a uhličitanech. Department of Chemistry, Indian Institute of Technology, Kanpur, India.



Zatím žádné komentáře