
Struktura, funkce a typy peroxidáz
The peroxidázy Jsou to z velké části hemeproteiny s enzymatickou aktivitou, které katalyzují oxidaci nejrůznějších organických a anorganických substrátů pomocí peroxidu vodíku nebo jiných příbuzných látek..
V nejširším slova smyslu termín „peroxidáza“ zahrnuje enzymy, jako jsou NAD- a NADP-peroxidázy, mastné kyseliny-peroxidázy, cytochrom-peroxidázy, glutathion-peroxidázy a mnoho dalších nespecifických enzymů..
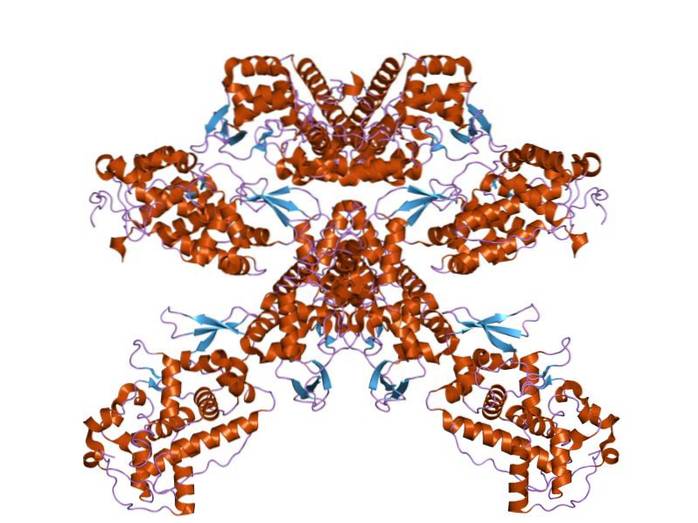
Běžněji se však používá k označení nespecifických enzymů z různých zdrojů, které mají aktivitu oxidoreduktázy a které používají peroxid vodíku a další substráty ke katalyzování svých oxidačně-redukčních reakcí..
Hemové peroxidázy jsou v přírodě extrémně běžné. Nalezeno u zvířat, vyšších rostlin, kvasinek, hub a bakterií.
U savců je produkují bílé krvinky, děloha, slezina a játra, slinné žlázy, stěny žaludku, plíce, štítné žlázy a další tkáně..
V rostlinách jsou rostlinnými druhy nejbohatšími na peroxidázy křen a fíkovníky. Peroxidáza purifikovaná z křenu byla rozsáhle studována a používána pro různé účely v experimentální biologii a biochemii..
V eukaryotických buňkách se tyto důležité enzymy obvykle nacházejí ve specializovaných organelách známých jako „peroxisomy“, které jsou obklopeny jedinou membránou a účastní se mnoha buněčných metabolických procesů..
Rejstřík článků
- 1 Struktura
- 2 funkce
- 2.1 Mechanismus působení
- 3 typy
- 3.1 - Podle těla
- 3.2 - Podle aktivního webu
- 4 Odkazy
Struktura
Navzdory malé homologii, která existuje mezi různými třídami peroxidáz, bylo zjištěno, že jejich sekundární struktura a způsob, jakým je organizována, je mezi různými druhy poměrně konzervativní..
Existuje několik výjimek, ale většina peroxidáz jsou glykoproteiny a předpokládá se, že sacharidy přispívají k jejich stabilitě při zvýšených teplotách..
Tyto proteiny mají molekulové hmotnosti v rozmezí od 35 do 150 kDa, což odpovídá přibližně 250 a 730 aminokyselinovým zbytkům..
S výjimkou myeloperoxidázy všechny molekuly tohoto typu obsahují ve své struktuře hemovou skupinu, která má v klidovém stavu atom železa v oxidačním stavu Fe + 3. Rostliny vlastní protetickou skupinu známou jako ferroporfyrin XI.
Peroxidázy mají dvě strukturní domény, které „obklopují“ hemovou skupinu, a každá z těchto domén je produktem exprese genu, který prošel duplikací. Tyto struktury se skládají z více než 10 alfa helixů spojených polypeptidovými smyčkami a obraty..
Zdá se, že správné složení molekuly závisí na přítomnosti konzervovaných glycinových a prolinových zbytků, stejně jako zbytku kyseliny asparagové a zbytku argininu, které mezi nimi tvoří solný můstek, který spojuje obě strukturní domény..
Funkce
Hlavní funkcí peroxidázových enzymů je odstranění peroxidu vodíku z buněčného prostředí, které může být produkováno různými mechanismy a které by mohlo představovat vážné ohrožení intracelulární stability..
V tomto procesu odstraňování těchto reaktivních forem kyslíku (ve kterém má kyslík střední oxidační stav) však peroxidázy využívají oxidační kapacitu této látky k plnění dalších důležitých funkcí pro metabolismus..
V rostlinách jsou tyto proteiny důležitou součástí lignifikačních procesů a obranných mechanismů v tkáních infikovaných patogeny nebo fyzicky poškozených..
Ve vědeckém kontextu se objevily nové aplikace peroxidáz, mezi něž patří čištění odpadních vod obsahujících fenolové sloučeniny, syntéza aromatických sloučenin a odstraňování peroxidu z potravin nebo odpadních materiálů..
Z analytického a diagnostického hlediska je křenová peroxidáza snad nejpoužívanějším enzymem pro přípravu konjugovaných protilátek, které se používají pro imunologické absorpční testy, jako je ELISA. "Enzymově vázaný imunosorbentní test") a také pro stanovení různých typů sloučenin.
Mechanismus účinku
Katalytický proces peroxidáz probíhá prostřednictvím postupných kroků, které začínají interakcí mezi aktivním místem enzymu a peroxidem vodíku, který oxiduje atom železa ve skupině hemu a vytváří nestabilní meziproduktovou sloučeninu známou jako sloučenina I (CoI).
Oxidovaný protein (CoI) má tedy hemovou skupinu s atomem železa, která přešla z oxidačního stavu III do stavu IV a pro tento proces byl peroxid vodíku redukován na vodu.
Sloučenina I je schopna oxidovat substrát donoru elektronů, tvořit substrátový radikál a stát se novým chemickým druhem známým jako sloučenina II (CoII), který je následně redukován druhou molekulou substrátu, regeneruje železo ve stavu III a produkuje další radikál.
Typy
-Podle těla
Peroxidázy jsou rozděleny do tří tříd v závislosti na organismu, kde se nacházejí:
- Třída I: intracelulární prokaryotické peroxidázy.
- Třída II: extracelulární fungální peroxidázy.
- Třída III: vylučované rostlinné peroxidázy.
Na rozdíl od proteinů třídy I mají proteiny třídy II a III disulfidové můstky zabudované mezi cysteinové zbytky ve svých strukturách, což jim dává podstatně větší tuhost..
Proteiny třídy II a III se také liší od třídy I v tom, že obecně mají na svém povrchu glykosylace..
-Podle aktivního webu
Mechanicky řečeno, peroxidázy lze také kategorizovat podle povahy atomů nalezených v jejich katalytickém centru. Tímto způsobem hemoperoxidázy (nejběžnější), vanad-haloperoxidázy a další.
Hemoperoxidázy
Jak již bylo zmíněno, tyto peroxidázy mají ve svém katalytickém centru známou jako hemová skupina protetickou skupinu. Atom železa na tomto místě je koordinován čtyřmi vazbami s atomy dusíku..
Vanad-haloperoxidázy
Místo hemové skupiny obsahují vanad-haloperoxidázy jako protetickou skupinu vanadát. Tyto enzymy byly izolovány z mořských organismů a některých suchozemských hub.
Vanad v této skupině je koordinován třemi neproteinovými kyslíky, dusíkem ze zbytku histidinu a dusíkem z azidové vazby..
Jiné peroxidázy
Mnoho bakteriálních haloperoxidáz, které mají protetické skupiny jiné než hem nebo vanad, je zařazeno do této skupiny. V této skupině jsou také glutathionperoxidázy, které obsahují seleno-cysteinovou protetickou skupinu a některé enzymy schopné oxidovat lignin..
Reference
- Alberts, B., Dennis, B., Hopkin, K., Johnson, A., Lewis, J., Raff, M., ... Walter, P. (2004). Základní buněčná biologie. Abingdon: Garland Science, Taylor & Francis Group.
- Banci, L. (1997). Strukturní vlastnosti peroxidáz. Journal of Biotechnology, 53, 253-263.
- Deurzen, M. P. J. Van, Rantwijk, F. Van a Sheldon, R. A. (1997). Selektivní oxidace katalyzované peroxidázami. Čtyřstěn, 53(39), 13183-13220.
- Dunford, H. B. a Stillman, J. S. (1976). O funkci a mechanismu účinku peroxidáz. Recenze koordinační chemie, 19, 187-251.
- Hamid, M., & Rehman, K. (2009). Potenciální aplikace peroxidáz. Chemie potravin, 115(4), 1177-1186.
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: vydavatelé Neil Patterson.
- Stansfield, W. D., Colomé, J. S., & Cano, R. J. (2003). Molekulární a buněčná biologie. (K.E. Cullen, ed.). Elektronické knihy McGraw-Hill.



Zatím žádné komentáře