
Struktura a funkce suché buňky
A suchá buňka je to baterie, jejíž elektrolytické médium se skládá z pasty a ne z roztoku. Uvedená pasta má však určitou úroveň vlhkosti, a proto není přísně suchá..
Malé množství vody je dostatečné pro pohyb iontů a následně pro tok elektronů uvnitř buňky..

Jeho obrovskou výhodou oproti prvním mokrým bateriím je to, že jelikož jde o elektrolytickou pastu, jeho obsah nelze rozlit; což byl případ mokrých baterií, které byly nebezpečnější a delikátnější než jejich suché protějšky. Vzhledem k nemožnosti rozlití nachází suchá buňka použití v mnoha přenosných a mobilních zařízeních.
Na obrázku výše je suchá zinko-uhlíková baterie. Přesněji řečeno, jedná se o moderní verzi stacku Georges Leclanché. Je to nejběžnější a možná i nejjednodušší.
Tato zařízení představují energetické pohodlí díky skutečnosti, že mají v kapse chemickou energii, kterou lze přeměnit na elektřinu; a tímto způsobem nezávisí na elektrických zásuvkách nebo energii dodávané velkými elektrárnami a jejich rozsáhlou sítí věží a kabelů.
Rejstřík článků
- 1 Struktura suché buňky
- 1.1 Elektrody
- 1.2 Terminály
- 1.3 Písek a vosk
- 2 Provoz
- 2.1 Oxidace zinkové elektrody
- 2.2 Redukce chloridu amonného
- 2.3 Stáhnout
- 3 Odkazy
Struktura suché buňky
Jaká je struktura suché buňky? Na obrázku vidíte jeho kryt, který není ničím jiným než polymerní fólií, ocelí a dvěma vývody, jejichž izolační podložky vyčnívají zepředu.
Je to však jen jeho vnější vzhled; jeho nejdůležitější části leží uvnitř, což zaručuje jeho správné fungování.
Každý suchý článek bude mít své vlastní vlastnosti, ale uvažuje se pouze se zinko-uhlíkovým článkem, jehož obecnou strukturu lze uvést pro všechny ostatní baterie..
Baterie se chápe jako spojení dvou nebo více baterií a druhé jsou galvanické články, jak bude vysvětleno v další části..
Elektrody
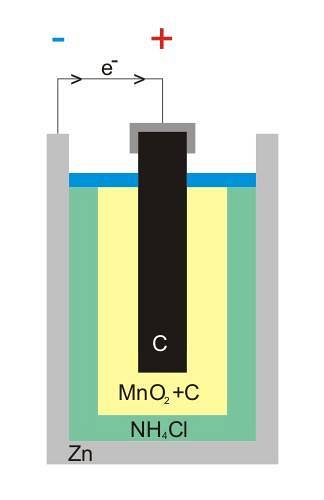
Horní obrázek ukazuje vnitřní strukturu zinko-uhlíkové baterie. Bez ohledu na to, co je to galvanický článek, vždy by měly být (obvykle) dvě elektrody: jedna, z níž jsou vydávány elektrony, a druhá, která je přijímá..
Elektrody jsou elektricky vodivé materiály, a aby mohl existovat proud, musí mít obě různé elektronegativity.
Například zinek, bílý cín, který obklopuje baterii, je místo, kde elektrony opouštějí elektrický obvod (zařízení), kde je připojen.
Na druhé straně je v celém médiu grafitová uhlíková elektroda; také ponořené do pasty složené z NH4Cl, ZnCldva a MnOdva.
Tato elektroda přijímá elektrony a všimněte si, že má symbol „+“, což znamená, že jde o kladný pól baterie.
Terminály
Jak je vidět na grafitové tyči na obrázku, je zde kladná elektrická svorka; a níže, vnitřní plechovka zinku, ze které proudí elektrony, záporný terminál.
Proto mají baterie značky „+“ nebo „-“, které označují správný způsob připojení k zařízení a umožňují tak jeho zapnutí..
Písek a vosk
I když to není zobrazeno, je pasta chráněna nárazníkovým pískem a voskovým těsněním, které jí brání v rozlití nebo v kontaktu s ocelí při menších mechanických nárazech nebo míchání..
Fungující
Jak funguje suchá buňka? Za prvé je to galvanický článek, to znamená, že vyrábí elektřinu z chemických reakcí. Proto v buňkách dochází k redoxním reakcím, při nichž druh získává nebo ztrácí elektrony..
Elektrody slouží jako povrch, který usnadňuje a umožňuje vývoj těchto reakcí. V závislosti na jejich nábojích může dojít k oxidaci nebo redukci druhu.
Abychom tomu lépe porozuměli, budou vysvětleny pouze chemické aspekty zinko-uhlíkové baterie..
Oxidace zinkových elektrod
Jakmile je elektronické zařízení zapnuto, baterie uvolní elektrony oxidací zinkové elektrody. To lze vyjádřit následující chemickou rovnicí:
Zn => Zndva+ + 2e--
Pokud je hodně Zndva+ kolem kovu dojde k polarizaci kladného náboje, takže nedojde k další oxidaci. Zndva+ musí difundovat pastou směrem ke katodě, kde elektrony vstoupí zpět.
Jakmile elektrony aktivují artefakt, vrátí se k druhé elektrodě: ke grafitové, kde najdou nějaké chemické druhy, které na ni „čekají“..
Redukce chloridu amonného
Jak již bylo uvedeno, v těstovinách je NH4Cl a MnOdva, látky, díky nimž je pH kyselé. Jakmile elektrony vstoupí, dojde k následujícím reakcím:
2NH4+ + 2e- => 2NH3 + Hdva
Tyto dva produkty, amoniak a molekulární vodík, NH3 a Hdva, jsou to plyny, a proto mohou „nabobtnat“ baterii, pokud neprocházejí jinými transformacemi; například následující dva:
Zndva+ + 4NH3 => [Zn (NH3)4]dva+
Hdva + 2MnOdva => 2MnO (OH)
Všimněte si, že amonium bylo redukováno (získané elektrony) na NH3. Tyto plyny byly poté neutralizovány ostatními složkami pasty..
Komplex [Zn (NH3)4]dva+ usnadňuje difúzi iontů Zndva+ směrem ke katodě, a tak zabránit „zhasnutí“ baterie.
Vnější obvod artefaktu funguje jako můstek pro elektrony; jinak by nikdy neexistovalo přímé spojení mezi zinkovou nádobou a grafitovou elektrodou. Na obrázku struktury by tento obvod představoval černý kabel.
Stažení
Suché články přicházejí v mnoha variantách, velikostech a provozním napětí. Některé z nich nejsou dobíjecí (primární galvanické články), zatímco jiné jsou (sekundární galvanické články).
Zinko-uhlíková baterie má pracovní napětí 1,5V. Jejich tvary se mění na základě jejich elektrod a složení jejich elektrolytů..
Dojde k bodu, kdy veškerý elektrolyt zreagoval, a bez ohledu na to, jak moc bude zinek oxidován, nebudou existovat žádné druhy, které přijímají elektrony a podporují jejich uvolňování..
Může se navíc jednat o případ, kdy vytvářené plyny již nejsou neutralizovány a zůstávají vyvíjeny tlakem uvnitř baterií..
Zinko-uhlíkové baterie a další baterie, které nelze dobíjet, je třeba recyklovat; protože jeho složky, zejména nikl-kadmiové složky, jsou škodlivé pro životní prostředí znečišťováním půdy a vod.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- "Suchá" baterie. Obnoveno z: makahiki.kcc.hawaii.edu
- Hoffman S. (10. prosince 2014). Co je to baterie se suchým článkem? Obnoveno z: upsbatterycenter.com
- Weed, Geoffrey. (24. dubna 2017). Jak fungují baterie se suchými články? Vědění. Obnoveno z: sciencing.com
- Woodford, Chris. (2016) Baterie. Obnoveno z: vysvetlitthatstuff.com.

Zatím žádné komentáře