
Vzorce a výpočet izochorických procesů, každodenní příklady

A izochorický proces Jedná se o všechny termodynamické procesy, při nichž objem zůstává konstantní. Tyto procesy se často nazývají izometrické nebo izovolumetrické. Obecně platí, že termodynamický proces může nastat při konstantním tlaku a proto se nazývá izobarický.
Pokud k němu dojde při konstantní teplotě, v takovém případě se jedná o izotermický proces. Pokud nedochází k výměně tepla mezi systémem a prostředím, nazývá se to adiabatické. Na druhou stranu, když existuje konstantní objem, generovaný proces se nazývá izochorický.
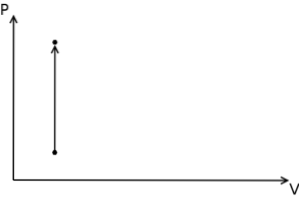
V případě izochorického procesu lze konstatovat, že v těchto procesech je tlakově-objemová práce nulová, protože to vyplývá z vynásobení tlaku zvětšením objemu.
Kromě toho jsou v diagramu termodynamického tlaku a objemu izochorické procesy reprezentovány ve formě svislé přímky..
Rejstřík článků
- 1 Vzorce a výpočet
- 1.1 První princip termodynamiky
- 2 Každodenní příklady
- 2.1 Ideální Otto cyklus
- 3 Praktické příklady
- 3.1 První příklad
- 3.2 Druhý příklad
- 4 Odkazy
Vzorce a výpočet
První princip termodynamiky
V termodynamice se práce počítá z následujícího výrazu:
W = P ∙ ∆ V
V tomto výrazu W je práce měřená v Joulech, P tlak měřený v Newtonech na metr čtvereční a ∆ V je změna nebo zvětšení objemu měřené v metrech krychlových..
Podobně takzvaný první princip termodynamiky stanoví, že:
∆ U = Q - W
V tomto vzorci W je práce vykonaná systémem nebo na systému, Q je teplo přijaté nebo emitované systémem a ∆ U je vnitřní variace energie systému. Při této příležitosti se tři veličiny měří v Joulech.
Protože v izochorickém procesu je práce nulová, ukazuje se, že:
∆ U = QPROTI (protože ∆ V = 0, a tedy W = 0)
Jinými slovy, změna vnitřní energie systému je způsobena pouze výměnou tepla mezi systémem a prostředím. V tomto případě se přenášené teplo nazývá konstantní objemové teplo..
Tepelná kapacita těla nebo systému je výsledkem dělení množství energie ve formě tepla přenášeného do těla nebo systému v daném procesu a změny teploty, kterou zažívá..
Když se proces provádí při konstantním objemu, mluvíme o tepelné kapacitě při konstantním objemu a označuje se Cproti (molární tepelná kapacita).
V takovém případě bude splněno:
Qproti = n ∙ C.proti ∙ ∆T
V této situaci je n počet molů, Cproti je výše uvedená molární tepelná kapacita při konstantním objemu a ∆T je zvýšení teploty, které zažívá tělo nebo systém.
Každodenní příklady
Je snadné si představit izochorický proces, je třeba myslet pouze na proces, který probíhá při konstantním objemu; tj. ve kterém kontejner, který obsahuje hmotu nebo hmotný systém, nemění svůj objem.
Příkladem může být případ (ideálního) plynu uzavřeného v uzavřené nádobě, jehož objem nelze změnit žádnými prostředky, kterými se dodává teplo. Předpokládejme případ plynu uzavřeného v láhvi.
Přenosem tepla na plyn, jak již bylo vysvětleno, skončí výsledkem zvýšení nebo zvýšení jeho vnitřní energie.
Opačný proces by byl postup plynu uzavřeného v nádobě, jejíž objem nelze změnit. Pokud je plyn ochlazen a poskytuje teplo prostředí, pak by se snížil tlak plynu a snížila by se hodnota vnitřní energie plynu.
Ideální Otto cyklus
Otto cyklus je ideálním případem cyklu používaného benzínovými stroji. Jeho počáteční použití však bylo ve strojích, které používaly zemní plyn nebo jiné druhy paliv v plynném stavu..
V každém případě je Ottův ideální cyklus zajímavým příkladem izochorického procesu. Nastává, když v automobilu s vnitřním spalováním dochází ke spalování směsi benzín-vzduch okamžitě.
V tomto případě dochází ke zvýšení teploty a tlaku plynu uvnitř válce, přičemž objem zůstává konstantní..
Praktické příklady
První příklad
Vzhledem k (ideálnímu) plynu uzavřenému ve válci vybaveném pístem uveďte, zda jsou následující případy příklady izochorických procesů.
- Na plynu se pracuje 500 J..
V tomto případě by se nejednalo o izochorický proces, protože k provádění prací na plynu je nutné jej stlačit, a proto změnit jeho objem.
- Plyn expanduje vodorovným posunutím pístu.
Opět by se nejednalo o izochorický proces, protože expanze plynu znamená změnu jeho objemu.
- Píst válce je upevněn tak, aby se nemohl pohybovat a plyn byl ochlazován.
Tentokrát by se jednalo o izochorický proces, protože by nedošlo k žádným objemovým změnám.
Druhý příklad
Určete kolísání vnitřní energie, které bude mít plyn obsažený v nádobě o objemu 10 litrů vystavené tlaku 1 atm, pokud jeho teplota vzroste z 34 ° C na 60 ° C v izochorickém procesu známém jako jeho molární specifické teplo. Cproti = 2.5R (bytost R = 8,31 J / mol K).
Jelikož se jedná o proces s konstantním objemem, dojde ke změně vnitřní energie pouze v důsledku tepla dodávaného do plynu. To je určeno následujícím vzorcem:
Qproti = n ∙ C.proti ∙ ∆T
Aby bylo možné vypočítat dodané teplo, je nejprve nutné vypočítat moly plynu obsažené v nádobě. K tomu je nutné uchýlit se k rovnici ideálního plynu:
P ∙ V = n ∙ R ∙ T
V této rovnici n je počet molů, R je konstanta, jejíž hodnota je 8,31 J / molK, T je teplota, P je tlak, kterému je plyn vystaven, měřený v atmosférách a T je teplota měřená v Kelvinech.
Vyřešte pro n a získejte:
n = R ∙ T / (P ∙ V) = 0,39 mol
Aby:
∆ U = QPROTI = n ∙ C.proti ∙ ∆T = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J
Reference
- Resnik, Halliday & Krane (2002). Fyzika Volume 1. Cecsa.
- Laider, Keith, J. (1993). Oxford University Press, ed. Svět fyzikální chemie.
- Tepelná kapacita. (n.d.). Na Wikipedii. Citováno 28. března 2018 z en.wikipedia.org.
- Latentní teplo. (n.d.). Na Wikipedii. Citováno dne 28. března 2018 z en.wikipedia.org.
- Isochorický proces. (n.d.). Na Wikipedii. Citováno 28. března 2018 z en.wikipedia.org.



Zatím žádné komentáře