
Jaké je emisní spektrum? (S příklady)

The emisní spektrum je spektrum vlnových délek světla emitovaného atomy a molekulami při přechodu mezi dvěma energetickými stavy. Bílé světlo nebo viditelné světlo dopadající na hranol se rozpadá na různé barvy se specifickými vlnovými délkami pro každou barvu. Získaný vzor barev je spektrum viditelného záření světla nazývané emisní spektrum.
Atomy, molekuly a látky mají také emisní spektrum v důsledku emise světla, když absorbují odpovídající množství energie zvenčí a přecházejí mezi dvěma energetickými stavy. Procházením tohoto světla hranolem se rozpadá na spektrální barevné čáry s různými vlnovými délkami každého prvku..
Význam emisního spektra spočívá v tom, že umožňuje určit složení neznámých látek a astronomických objektů pomocí analýzy jejich spektrálních čar pomocí technik emisní spektroskopie..
Dále je vysvětleno, z čeho se emisní spektrum skládá a jak je interpretováno, jsou zmíněny některé příklady a rozdíly, které existují mezi emisním a absorpčním spektrem.
Rejstřík článků
- 1 Co je to emisní spektrum?
- 2 Interpretace emisního spektra
- 3 Rozdíl mezi emisním a absorpčním spektrem.
- 4 Příklady emisních spekter chemických prvků
- 5 Reference
Co je to emisní spektrum?
Atomy prvku nebo látky mají elektrony a protony, které jsou drženy pohromadě díky elektromagnetické přitažlivé síle. Podle Bohrova modelu jsou elektrony uspořádány tak, aby energie atomu byla co nejnižší. Tato úroveň energetické energie se nazývá základní stav atomu..
Když atomy získávají energii zvenčí, elektrony se pohybují směrem k vyšší energetické úrovni a atom mění základní stav na vzrušený..
V excitovaném stavu je doba zdržení elektronu velmi malá (≈ 10-8 s) (1), atom je nestabilní a vrací se do základního stavu, v případě potřeby prochází mezilehlými energetickými hladinami.
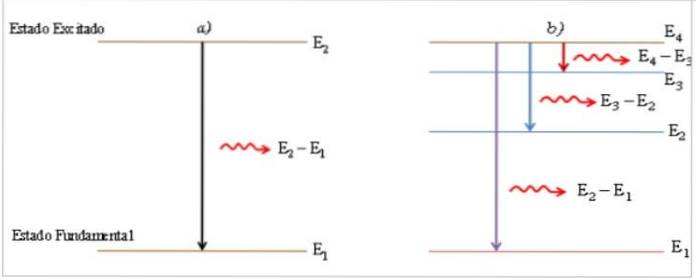
V procesu přechodu z excitovaného stavu do základního stavu atom emituje foton světla s energií rovnou energetickému rozdílu mezi těmito dvěma stavy, přičemž je přímo úměrný frekvenci v a nepřímo úměrný jeho vlnové délce λ.
Vyzařovaný foton je zobrazen jako jasná čára, která se nazývá spektrální čára (2), a distribuce spektrální energie kolekce emitovaných fotonů na přechodech atomu je emisní spektrum.
Interpretace emisního spektra
Některé přechody atomu jsou způsobeny zvýšením teploty nebo přítomností jiných vnějších zdrojů energie, jako je paprsek světla, proud elektronů nebo chemická reakce..
Pokud je plyn, jako je vodík, umístěn v komoře při nízkém tlaku a komorou prochází elektrický proud, bude vyzařovat světlo s vlastní barvou, která ho odlišuje od ostatních plynů..
Procházením emitovaného světla hranolem se místo získání duhy světla získávají diskrétní jednotky ve formě barevných čar se specifickými vlnovými délkami, které přenášejí diskrétní množství energie.
Řádky emisního spektra jsou v každém prvku jedinečné a jejich použití ze spektroskopické techniky umožňuje určit elementární složení neznámé látky i složení astronomických objektů analýzou vlnových délek emitovaných fotonů během přechodu atomu..
Rozdíl mezi emisním a absorpčním spektrem.
V procesech absorpce a emise má atom přechody mezi dvěma energetickými stavy, ale v absorpci získává energii zvenčí a dosahuje stavu excitace..
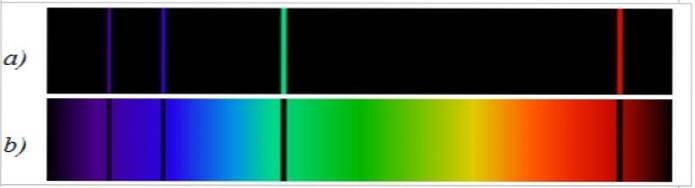
Spektrální čára vyzařování je opačná ke spojitému spektru bílého světla. V první je spektrální distribuce pozorována ve formě jasných čar a ve druhé je pozorován spojitý barevný pás..
Pokud paprsek bílého světla narazí na plyn, jako je vodík, uzavřený v komoře za nízkého tlaku, bude pouze část světla absorbována plynem a zbytek bude přenesen.
Když procházející světlo prochází hranolem, rozpadá se na spektrální čáry, každá s jinou vlnovou délkou, a tvoří absorpční spektrum plynu..
Absorpční spektrum je zcela opačné než emisní spektrum a je také specifické pro každý prvek. Při porovnávání obou spekter stejného prvku je pozorováno, že emisní spektrální čáry jsou ty, které chybí v absorpčním spektru (obrázek 2).
Příklady emisních spekter chemických prvků
a) Spektrální čáry atomu vodíku ve viditelné oblasti spektra jsou červená čára 656,3 nm, světle modrá 486,1 nm, tmavě modrá 434 nm a velmi slabá fialová 410 nm. Tyto vlnové délky jsou získány z rovnice Balmer - Rydberg v její moderní verzi (3).
je vlnové číslo spektrální čáry
je Rydbergova konstanta (109666,56 cm-1)
je nejvyšší úroveň energie
je nejvyšší úroveň energie

b) Emisní spektrum helia má dvě řady hlavních linií, jednu ve viditelné oblasti a druhou v blízkosti ultrafialového záření. Peterson (4) použil Bohrův model k výpočtu řady emisních linií helia ve viditelné části spektra v důsledku několika současných přechodů dvou elektronů do stavu n = 5 a získaných hodnot konzistentních vlnových délek s experimentálními výsledky. Získané vlnové délky jsou 468,8 nm, 450,1 nm, 426,3 nm, 418,4 nm, 412,2 nm, 371,9 nm.
c) Emisní spektrum sodíku má dvě velmi jasné linie 589 nm a 589,6 nm nazývané linie D (5). Ostatní řádky jsou mnohem slabší než tyto a z praktických důvodů je veškeré sodíkové světlo považováno za světlo pocházející z řádků D..
Reference
- Měření životností excitovaných stavů atomu vodíku. V. A. Ankudinov, S. V. Bobashev a E. P. Andreev. 1, 1965, Soviet Physics JETP, sv. 21, str. 26-32.
- Demtröder, W. Laser Spectroscopy 1. Kaiserslautern: Springer, 2014.
- D.K. Rai, S.N Thakur a. Atom, laser a spektroskopie. Nové Dillí: Phi Learning, 2010.
- Bohr Revisited: Modelové a spektrální linie helia. Peterson, C. 5, 2016, Journal of mladých vyšetřovatelů, sv. 30, str. 32-35.
- Journal of Chemical Education. J.R. Appling, F. J. Yonke, R. A. Edgington a S. Jacobs. 3, 1993, sv. 70, str. 250-251.


Zatím žádné komentáře