
Endotermická a exotermická reakce

A endotermická reakce vyžaduje energii, zatímco exotermická reakce uvolňuje energii. Tato klasifikace chemických reakcí bere v úvahu účast energie buď jako reaktantu nebo jako produktu..
Energie je schopnost pracovat nebo vyrábět teplo. Pamatujte, že chemické reakce zahrnují reorganizaci atomů mezi látkami s rozbitím nebo tvorbou chemických vazeb. Obecně je tato tvorba nebo rozbití chemických vazeb doprovázena změnami energie systému..
| Endotermická reakce | Exotermická reakce | |
|---|---|---|
| Definice | Chemická reakce, při které je energie absorbována. | Chemická reakce, při které se energie uvolňuje ve formě tepla. |
| Původ energie | Životního prostředí | Systému |
| Potenciální energie | Nižší v reaktantech než v produktech. | Více v reaktantech než v produktech. |
| Výroba | Ne spontánní | Spontánní |
| Změna vnitřní energie | AE> 0; změna vnitřní energie větší než nula. | ΔE<0; cambio de energía interna menor que cero. |
| Teplota | Snižuje se | Zvyšuje |
| Příklady | Reakce ve fotosyntéze a syntéze obecně. | Hořící zápalka, spalovací reakce. |
Co je endotermická reakce?
Chemická reakce je endotermická, když absorbuje energii z prostředí. V tomto případě se teplo přenáší z vnějšku do vnitřku systému. Když umístíme teploměr, zatímco probíhá endotermická reakce, teplota klesá.
Slovo „endotermické“ pochází z řečtiny endon což znamená „uvnitř“ a Therme což znamená „teplo“. Endotermické reakce neprobíhají spontánně.
Odkud pochází energie v endotermických reakcích?
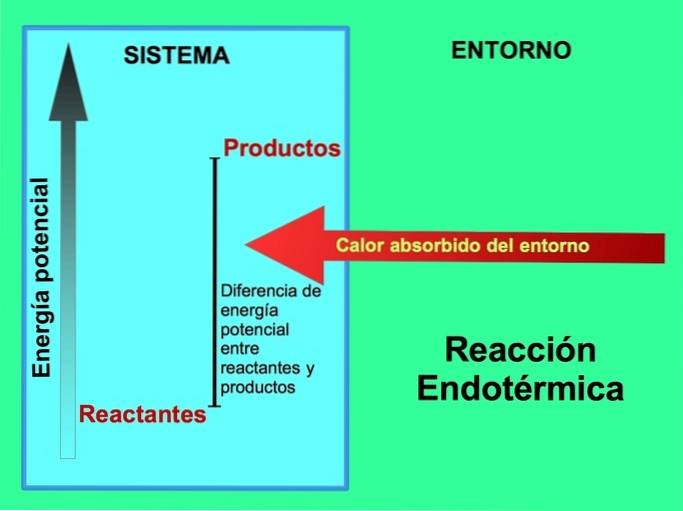
Při endotermických reakcích pochází energie z prostředí mimo systém. Množství potenciální energie produktů je větší než potenciální energie reaktantů. Proto je nutné, aby reakční složky přidaly energii, aby reakce mohla pokračovat. Tato energie pochází z tepla prostředí.
Například, fotosyntéza je endotermický proces, kde rostliny zachycují sluneční energii k výrobě glukózy z oxidu uhličitého a kyslíku:

Produkty fotosyntetické reakce, glukóza a kyslík, mají větší množství potenciální energie, pokud jde o reaktanty, oxid uhličitý a vodu. Další příklady endotermických chemických reakcí s množstvím použité energie:

Příklady endotermické reakce
Reakce probíhají nejen v chemické laboratoři. Denně také nacházíme situace, kdy dochází k endotermickým reakcím.
Vaří jídlo
I když se to nemusí zdát, proces vaření jídla je endotermický. Abychom mohli konzumovat určitá jídla, musíme jim dodávat teplo.
Okamžitý studený vak
Studené zábaly používané k ošetření hrbolů nebo vyvrtnutí jsou naplněny vodou, ale při protřepání nebo klepání se uvnitř rozbije kapsle obsahující dusičnan amonný. Smíchání dusičnanu amonného s vodou je endotermická reakce, která způsobí ochlazení vaku.
Co je exotermická reakce?
A exotermická reakce je reakce, při které ze systému proudí energie. Tato energie se uvolňuje ve formě tepla, takže umístění teploměru v reakčním systému zvyšuje teplotu.
Slovo „exotermické“ tvoří exo což znamená "ven" a termy, což znamená „teplo“. Exotermické reakce mohou nastat spontánně a v některých případech mohou být výbušné, například kombinace alkalických kovů a vody.
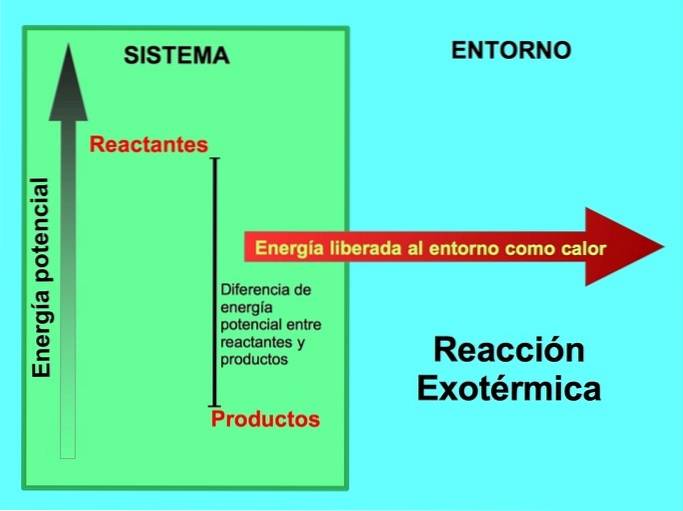
Odkud pochází energie v exotermických reakcích?
Při chemické reakci jsou reaktanty sloučeniny, které se transformují a produkují produkty. Například, když sodík reaguje s chlorem Cl, jedná se o reaktanty a produktem je chlorid sodný NaCl:
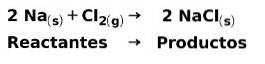
Reaktanty i produkty mají uloženou potenciální energii. Víme z lúspora energie tato energie není ani ztracena, ani získána, takže energie reaktantů musí být stejná jako energie produktů.
Při exotermické reakci lreaktanty mají více potenciální energie ve srovnání s produkty, tak se přebytečná energie uvolňuje jako teplo. V tomto případě je energie také považována za součást produktů:

V každém exotermickém procesu se část potenciální energie uložené v chemických vazbách přeměňuje na tepelnou energii prostřednictvím tepla..
Příklady exotermické reakce
Prací prášek
Když rozpustíme trochu pracího prášku s vodou v našich rukou, cítíme mírné zahřívání.
Spalování domácího plynu
Spalování plynů pro domácí použití, jako je methan nebo butan, zahrnuje chemickou reakci s kyslíkem za vzniku oxidu uhličitého a vody a uvolnění energie. Toto je typická exotermická reakce při každodenním používání:
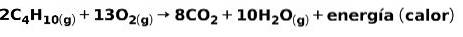
Energie uvolněná při spalování se používá k vaření jídla.
Také by vás mohlo zajímat, co jsou otevřený systém, uzavřený systém a izolovaný systém.


Zatím žádné komentáře