
Jednoduché, dvojité posunutí reakce a příklady
The vytěsňovací reakce jsou všechny ty, ve kterých chemická látka vytěsňuje jinou ve sloučenině. Toto posunutí může být jednoduché nebo dvojité, liší se tím, že v prvním je to prvek, který je přemístěn, zatímco ve druhém dochází ke změně „párů“ mezi dvěma sloučeninami..
Tyto typy reakcí jsou možné pouze za určitých podmínek: jeden z druhů musí mít oxidační číslo nula nebo všechny musí být nutně ionizovány. Co znamená číslo oxidace nula? To znamená, že druh je v přirozeném stavu.

Velmi ilustrativním příkladem výše uvedeného přístupu je reakce mezi měděným drátem a roztokem dusičnanu stříbrného. Protože měď je kov ve svém přirozeném stavu, je jeho oxidační číslo nulové; na druhé straně je stříbro +1 (Ag+), který leží rozpuštěný společně s dusičnanovými ionty (NO3-).
Kovy se vzdávají elektronů, ale některé jsou aktivnější než jiné; To znamená, že ne všechny kovy tak snadno reznou. Protože měď je aktivnější než stříbro, daruje své elektrony, čímž ji redukuje do svého přirozeného stavu, což se odráží jako stříbrný povrch, který pokrývá měděný drát (obrázek výše).
Rejstřík článků
- 1 Reakce posunutí
- 1.1 Jednoduché
- 1,2 Double
- 2 Příklady
- 2.1 Jednoduché
- 2.2 Double
- 3 Odkazy
Reakce posunutí
Jednoduchý
Výtlak vodíku a kovů
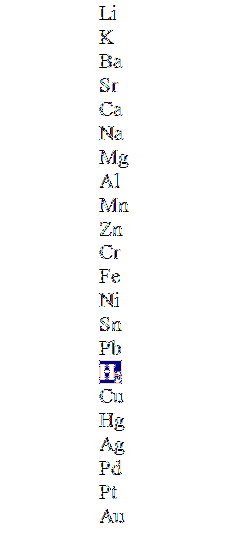
Horní obrázek ukazuje sloupec v sestupném pořadí aktivity, zvýrazňující molekulu vodíku. Tyto kovy, které jsou nad ním, ho mohou přemístit do neoxidujících kyselin (HCl, HF, HdvaSW4, atd.) a ti níže nebudou vůbec reagovat.
Jednoduchou reakci posunutí lze popsat následující obecnou rovnicí:
A + BC => AB + C
A vytěsňuje C, což může být molekula Hdva nebo jiný kov. Ano, Hdva vzniká redukcí iontů H+ (2H+ + 2e- => Hdva), pak druh A musí - kvůli zachování hmoty a energie - poskytnout elektrony: musí být oxidován.
Na druhou stranu, pokud A a C jsou kovové druhy, ale C je v iontové formě (M+) a A ve svém přirozeném stavu, pak k vytěsňovací reakci dojde pouze v případě, že A je aktivnější než C, což donutí druhého přijímat elektrony k redukci do svého kovového stavu (M).
Zdvihový objem s halogeny
Stejným způsobem se mohou halogeny (F, Cl, Br, I, At) pohybovat navzájem, ale po jiné sérii činností. U nich aktivita klesá, když člověk sestupuje přes skupinu 7A (nebo 17): I Například následující reakce probíhá přirozeně: Fdva(g) + 2NaI (ac) => 2NaF (ac) + Idva(s) Tento jiný však neprodukuje žádné produkty z důvodů, které byly právě vysvětleny: Jádva(s) + NaF (ac) => X Ve výše uvedené rovnici X znamená, že nedochází k žádné reakci. S těmito znalostmi lze předvídat, která směs halogenových solí s čistými prvky produkuje produkty. Pravidlem je, že jod (těkavá fialová pevná látka) nevytlačuje žádný z ostatních halogenů, ale ostatní jej vytěsňují, když jsou v iontové formě (Na+ Já-). Reakce dvojitého vytěsnění, známá také jako reakce metatese, je znázorněna následovně: AB + CD => AD + CB Tentokrát nejen A vytěsňuje C, ale také B vytěsňuje D. K tomuto typu vytěsnění dochází pouze tehdy, když jsou smíchány roztoky rozpustných solí a vytvoří se sraženina; tj. AD nebo CB musí být nerozpustné a musí mít silné elektrostatické interakce. Například při míchání řešení KBr a AgNO3, čtyři ionty se pohybují médiem, dokud nevytvoří odpovídající páry rovnice: KBr (ac) + AgNO3(ac) => AgBr (s) + KNO3(ac) Ag ionty+ a Br- tvoří sraženinu bromidu stříbrného, zatímco K+ a žádná3- nemohou být uspořádány tak, aby tvořily krystal dusičnanu draselného. Když je kyselina neutralizována zásadou, dojde k reakci s dvojitým vytěsněním: HCl (vodný) + NaOH (vodný) => NaCl (vodný) + HdvaO (l) Zde se netvoří sraženina, protože chlorid sodný je velmi rozpustná sůl ve vodě, ale dochází ke změně pH, která se upravuje na hodnotu blízkou 7. V následující reakci však současně dochází ke změně pH a tvorbě sraženiny: H3PO4(ac) + 3Ca (OH)dva => Ca3(PO4)dva(s) + 3HdvaO (l) Fosforečnan vápenatý je nerozpustný, sráží se jako bílá pevná látka, zatímco kyselina fosforečná je neutralizována hydroxidem vápenatým. Cu (y) + 2AgNO3(ac) => Cu (NO3)dva(ac) + 2 Ag (s) Toto je obrazová reakce měděného drátu. Když se podíváte na řadu chemických aktivit pro kovy, zjistíte, že měď je nad stříbrem, takže ji může vytlačit. Zn (y) + CuSO4(ac) => ZnSO4(ac) + Cu (y) U této další reakce nastává opak: nyní namodralý roztok CuSO4 stává se transparentní, protože měď se vysráží jako kov a zároveň se kovový zinek rozpadá na rozpustnou sůl síranu zinečnatého. 2 Al (y) + 3 NiBrdva(ac) => 2 AlBr3(ac) + 3Ni (s) K této reakci opět dochází, protože hliník je v řadě chemických činností nad niklem. Sn (s) + HdvaSW4(ac) => SnSO4(ac) + Hdva(G) Zde cín vytěsňuje vodík, i když je mu v sérii velmi blízký. 2K (s) + 2HdvaO (l) => 2KOH (aq) + Hdva(G) A konečně, ty kovy, které jsou v nejvyšší části série, jsou tak reaktivní, že vytěsňují dokonce vodík v molekulách vody, což vytváří velmi exotermickou (a výbušnou) reakci.. Zn (č3)dva(aq) + 2NaOH (aq) => Zn (OH)dva(s) + 2NaNO3(ac) I když báze neutralizuje žádné kyseliny, OH ionty- cítit větší afinitu k Zndva+ že ionty NEJSOU3-; z tohoto důvodu dochází k dvojímu posunutí. Razítko3)dva(ac) + NadvaS (ac) => CuS (s) + 2NaNO3(ac) Tato reakce je velmi podobná té předchozí, s tím rozdílem, že obě sloučeniny jsou soli rozpuštěné ve vodě..Dvojnásobek
Acidobazická neutralizační reakce
Příklady
Jednoduchý
Dvojnásobek
Reference


Zatím žádné komentáře