
Vlastnosti organických solí, použití a příklady

The organické soli jsou to hustý počet iontových sloučenin s nesčetnými vlastnostmi. Jsou dříve odvozeny z organické sloučeniny, která prošla transformací, která jí umožňuje nést náboj, a také její chemická identita závisí na přidruženém iontu.
Na obrázku níže jsou uvedeny dva velmi obecné chemické vzorce pro organické soli. První z nich, R-AX, je interpretován jako sloučenina, v jejíž uhlíkové struktuře atom nebo skupina A nese kladný nebo záporný náboj (-).
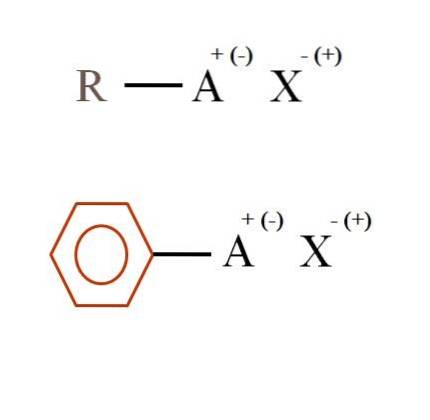
Jak je vidět, existuje kovalentní vazba mezi R a A, RA, ale zase A má formální náboj, který přitahuje (nebo odpuzuje) iont X. Znamení náboje bude záviset na povaze A a chemické prostředí.
Pokud by A byly kladné, s kolika X by to mohlo interagovat? Pouze s jedním, vzhledem k principu elektroneutality (+ 1-1 = 0). Jaká je však identita X? Anion X může být CO3dva-, vyžadující dva RA kationty+; halogenid: F-, Cl-, Br-, atd.; nebo dokonce jiná sloučenina RA-. Možnosti jsou nevyčíslitelné.
Organická sůl může mít také aromatický charakter, což dokládá hnědý benzenový kruh. Benzoátová sůl mědi (II), (C.6H5VRKAT)dvaCu se například skládá ze dvou aromatických kruhů se záporně nabitými karboxylovými skupinami, které interagují s kationem Cu.dva+.
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 1.1 Vysoké molekulové hmotnosti
- 1.2 Amfifilní látky a povrchově aktivní látky
- 1.3 Vysoké teploty varu nebo teploty tání
- 1.4 Kyselost a zásaditost
- 2 použití
- 3 Příklady organických solí
- 3.1 Karboxyláty
- 3.2 Lithium diakylcuprates
- 3.3 Sulfoniové soli
- 3.4 Oxoniové soli
- 3.5 Aminové soli
- 3.6 Diazoniové soli
- 4 Odkazy
Fyzikální a chemické vlastnosti
Z obrázku lze říci, že organické soli se skládají ze tří složek: organické, R nebo Ar (aromatický kruh), atomu nebo skupiny, která nese iontový náboj A, a protiion X.
Stejně jako jsou těmito složkami definovány identita a chemická struktura, stejně tak na nich závisí jejich vlastnosti..
Z této skutečnosti lze shrnout určité obecné vlastnosti, které drtivá většina těchto solí splňuje..
Vysoké molekulové hmotnosti
Předpokládáme-li jedno nebo vícemocné anorganické anionty X, organické soli mají tendenci mít mnohem větší molekulové hmotnosti než anorganické soli. Je to hlavně díky uhlíkovému skeletu, jehož jednotlivé vazby C-C a jejich atomy vodíku přispívají ke sloučenině velkou hmotou..
Proto jsou R nebo Ar zodpovědné za své vysoké molekulové hmotnosti..
Amfifilní látky a povrchově aktivní látky
Organické soli jsou amfifilní sloučeniny, to znamená, že jejich struktury mají hydrofilní i hydrofobní konce..
Jaké jsou takové extrémy? R nebo Ar představují extrémně hydrofobní, protože jejich atomy C a H nemají velkou afinitu k molekulám vody.
NA+(-), atom nebo skupina nesoucí náboj je hydrofilní konec, protože přispívá k dipólnímu momentu a interaguje s vodou za vzniku dipólů (RA+ Achdva).
Když jsou hydrofilní a hydrofobní oblasti polarizovány, stává se z amfifilní soli povrchově aktivní látka, látka široce používaná pro výrobu detergentů a deemulgátory.
Vysoké teploty varu nebo tání
Stejně jako anorganické soli mají i organické soli vysoké teploty tání a teploty varu kvůli elektrostatickým silám, které řídí kapalnou nebo pevnou fázi..
Jelikož však existuje organická složka R nebo Ar, účastní se i jiné typy Van der Waalsových sil (londýnské síly, dipól-dipól, vodíkové vazby), které určitým způsobem soutěží s elektrostatikou..
Z tohoto důvodu jsou pevné nebo kapalné struktury organických solí v první řadě složitější a rozmanitější. Někteří se dokonce mohou chovat jako tekuté krystaly.
Kyselost a zásaditost
Organické soli jsou obecně silnější kyseliny nebo zásady než anorganické soli. Je to proto, že A, například v aminových solích, má kladný náboj díky své vazbě s dalším vodíkem: A+-H. Poté při kontaktu s bází darujte proton, aby se stal opět neutrální sloučeninou:
RA+H + B => RA + HB
H patří k A, ale je psáno, protože se účastní neutralizační reakce.
Na druhou stranu, RA+ Může to být velká molekula, která není schopna tvořit pevné látky s dostatečně stabilní krystalovou mřížkou s hydroxylovým nebo hydroxylovým aniontem OH-.
Pokud je to tak, RA sůl+Ach- chová se jako silná základna; stejně zásaditý jako NaOH nebo KOH:
RA+Ach- + HCl => RACl + HdvaNEBO
V chemické rovnici si povšimněte, že anion Cl- nahrazuje OH-, tvořící sůl RA+Cl-.
Aplikace
Použití organických solí se bude lišit podle identity R, Ar, A a X. Kromě toho jejich použití závisí také na typu pevné nebo kapalné látky, kterou tvoří. Některé obecnosti v tomto ohledu jsou:
-Slouží jako činidla pro syntézu dalších organických sloučenin. RAX může působit jako „dárce“ pro řetězec R, který se přidá k jiné sloučenině, která nahradí dobře odstupující skupinu.
-Jsou to povrchově aktivní látky, takže je lze také použít jako maziva. K tomuto účelu se používají kovové soli karboxylátů.
-Umožňují syntetizovat širokou škálu barviv.
Příklady organických solí
Karboxyláty
Karboxylové kyseliny reagují s hydroxidem při neutralizační reakci, čímž vznikají karboxylátové soli: RCOO- M+; kde M+ může to být jakýkoli kovový kation (Na+, Pbdva+, K.+, atd.) nebo amonný kation NH4+.
Mastné kyseliny jsou karboxylové kyseliny s dlouhým alifatickým řetězcem, mohou být nasycené a nenasycené. Mezi nasycené patří kyselina palmitová (CH3(CHdva)14COOH). Vzniká palmitátová sůl, zatímco kyselina stearová (CH3(CHdva)16COOH tvoří stearátovou sůl. Z těchto solí jsou vyrobena mýdla.
V případě kyseliny benzoové C6H5COOH (kde C6H5- je benzenový kruh), když reaguje s bází, tvoří benzoátové soli. Ve všech karboxylátech skupina -COO- představuje A (RAX).
Lithium diakylcuprates
Lithium diakylcuprate je užitečný v organické syntéze. Jeho vzorec je [R-Cu-R]-Li+, ve kterém atom mědi nese záporný náboj. Zde měď představuje atom A na obrázku.
Sulfoniové soli
Vznikají reakcí organického sulfidu s alkylhalogenidem:
RdvaS + R'X => RdvaR'S+X
U těchto solí nese atom síry pozitivní formální náboj (S.+) tím, že má tři kovalentní vazby.
Oxoniové soli
Stejně tak ethery (okysličené analogy sulfidů) reagují s hydrracidy za vzniku oxoniových solí:
ROR '+ HBr <=> RO+HR '+ Br-
Kyselý proton HBr je kovalentně navázán na atom kyslíku etheru (R.dvaNEBO+-H), nabíjení pozitivně.
Aminové soli
Aminy mohou být primární, sekundární, terciární nebo kvartérní, podobně jako jejich soli. Všechny jsou charakterizovány tím, že mají atom H spojený s atomem dusíku.
Tedy RNH3+X- je primární aminová sůl; RdvaNHdva+X-, sekundární amin; R3NH+X-, terciární amin; a R.4N+X-, kvartérní amin (kvartérní amonná sůl).
Diazoniové soli
Nakonec diazoniové soli (RNdva+X-) nebo aryldiazonium (ArNdva+X-), představují výchozí bod mnoha organických sloučenin, zejména azobarviv.
Reference
- Francis A. Carey. Organická chemie. (Šesté vydání, strany 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. Organická chemie. Miny. (10. vydání.). Wiley plus.
- Wikipedia. (2018). Sůl (chemie). Převzato z: en.wikipedia.org
- Steven A. Hardinger. (2017). Ilustrovaný glosář organické chemie: soli. Obnoveno z: chem.ucla.edu
- Chevron Oronite. (2011). Karboxyláty. [PDF]. Obnoveno z: oronite.com



Zatím žádné komentáře