
Koncept, postup a příklady progresivní sublimace

The progresivní sublimace Jedná se o termodynamický proces, při kterém dochází ke změně endotermického stavu přímo z pevné látky na plyn bez předchozí tvorby kapaliny. Chování pevné látky za normálních podmínek je zahřátí a roztavení; to znamená sloučit. Mezitím při sublimaci pevná látka začne kouřit přímo, aniž by se dříve objevily kapky, které by svědčily o jejím tání..
To, co je popsáno v předchozím odstavci, je znázorněno na obrázku výše. Předpokládejme pevnou oranžovou směs (vlevo), která se začne zahřívat. Směs se skládá ze dvou složek nebo pevných látek: jedné žluté a druhé červené, jejichž kombinace vede k oranžové barvě..
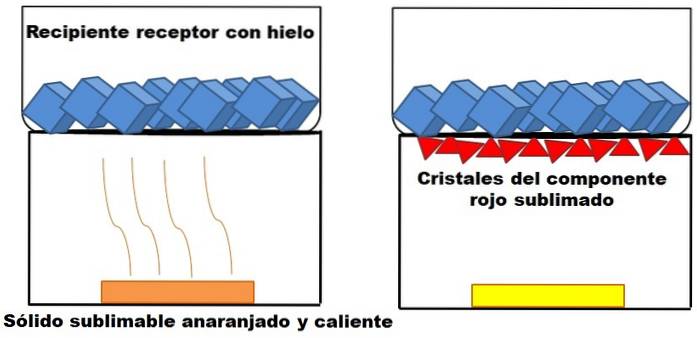
Červená pevná látka sublimuje, protože se z ní netvoří kapalina, ale končí usazená (červené trojúhelníky) na dně horní nádoby; ten, který obsahuje kostky ledu, a proto nabízí studený povrch. Mezitím žlutá pevná látka zůstává nezměněna teplem (žlutý obdélník).
Červené trojúhelníky nebo krystaly se ukládají díky studenému povrchu přijímací nádoby (vpravo), který absorbuje jejich teplotu; A i když to není zobrazeno, velikost vašich kostek ledu by se měla snížit kvůli absorpci tepla. Žlutá pevná látka není sublimovatelná, a pokud ji budete dříve či později zahřívat, roztaví se.
Rejstřík článků
- 1 Koncept progresivní sublimace
- 1.1 Proces
- 1.2 Od pevné struktury k plynným poruchám
- 1.3 Fázový diagram a trojitý bod
- 1.4 Podmínky
- 2 Příklady
- 2.1 Čištění pevných látek
- 2.2 Syntéza krystalů
- 3 Odkazy
Koncept progresivní sublimace
Proces
Již bylo řečeno, že sublimace je endotermická změna stavu, protože k jejímu uskutečnění musí existovat absorpce tepla. Pokud pevná látka absorbuje teplo, její energie se zvýší, takže její částice budou také vibrovat na vyšších frekvencích..
Když se tyto vibrace stanou velmi silnými, nakonec ovlivní mezimolekulární interakce (ne kovalentní vazby); a v důsledku toho dříve nebo později částice od sebe vzdálí větší vzdálenosti, dokud se jim nepodaří volně proudit a pohybovat se oblastmi vesmíru.
V některých pevných látkách jsou vibrace tak silné, že některé částice „vystřelují“ ze struktury, místo aby se aglomerovaly v pohybujících se shlucích, které definují kapičku. Tyto částice unikají a tvoří první „bublinu“, která by raději vytvořila první páry sublimované pevné látky..
Nemluvíme tedy o bodu tání, ale o bodu sublimace. I když jsou oba závislé na tlaku převládajícím na pevnou látku, sublimační bod je spíše; proto se jeho teplota výrazně mění se změnami tlaku (stejně jako teplota varu).
Od pevné struktury k plynným poruchám
Při sublimaci se také říká, že dochází ke zvýšení entropie systému. Energetické stavy částic přecházejí z toho, že jsou omezeny jejich pevnými polohami v pevné struktuře, k homogenizaci v jejich vrtošivých a chaotických směrech v plynném stavu, rovnoměrnějším, kde nakonec získávají průměrnou kinetickou energii..
Fázový diagram a trojitý bod
Sublimační bod závisí na tlaku; protože jinak by pevné částice absorbovaly teplo, aby nevystřelovaly do prostoru mimo pevnou látku, ale aby vytvářely kapičky. Nebylo by to sublimováno, ale roztavilo by se to nebo by se roztavilo, jak je obvyklé.
Čím větší je vnější tlak, tím méně je pravděpodobná sublimace, protože pevná látka je nucena tát.
Ale které pevné látky jsou sublimovatelné a které ne? Odpověď spočívá ve vašich fázových diagramech P vs T, jako je uvedeno níže:
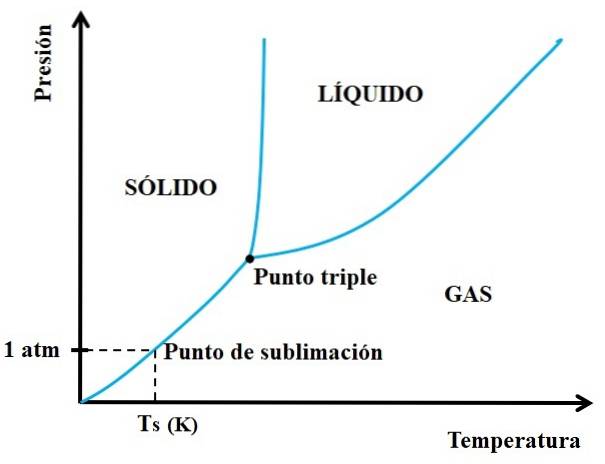
Nejprve se musíme podívat na trojný bod a projít spodní částí: částí, která odděluje pevné a plynné stavy. Všimněte si, že v oblasti pevné látky musí dojít k poklesu tlaku, aby došlo k sublimaci (nemusí to být nutně 1 atm, náš atmosférický tlak). V 1 atm bude hypotetická látka sublimovat při teplotě Ts vyjádřené v K..
Čím delší a vodorovnější je úsek nebo křivka pod trojitým bodem, tím větší je kapacita tělesa sublimovat při různých teplotách; ale pokud je hluboko pod 1 atm, pak bude k dosažení sublimace zapotřebí vysokého vakua, a to takovým způsobem, že se sníží tlaky (například 0,0001 atm).
Podmínky
Pokud je trojitý bod tisíckrát nižší než atmosférický tlak, pevná látka se nikdy sublimuje ani při použití ultravakua (nemluvě o jeho náchylnosti k rozkladu působením tepla).
Pokud tomu tak není, provádí se sublimace mírným zahříváním a podrobením pevné látky vakuu, aby její částice unikly snadněji, aniž by bylo nutné absorbovat tolik tepla..
Sublimace se stává velmi důležitou, když se jedná zejména o pevné látky s vysokým tlakem par; tj. tlak uvnitř, odraz účinnosti jejich interakcí. Čím vyšší je jeho tlak par, tím je voňavější a sublimovatelnější..
Příklady
Čištění pevných látek
Obrázek oranžové pevné látky a její sublimovatelné načervenalé složky je příkladem toho, co sublimace představuje, protože se týká čištění pevných látek. Červené trojúhelníky lze podle potřeby znovu sublimovat, dokud není zaručena vysoká čistota.
Tato technika se většinou používá u vonných pevných látek. Například: kafr, kofein, benzoin a mentol.
Mezi další pevné látky, které lze sublimovat, patří: jód, led (ve vysokých nadmořských výškách), teobromin (z čokolády), sacharin, morfin a další drogy, dusíkaté zásady a antracen.
Syntéza krystalů
Po návratu k červeným trojúhelníkům nabízí sublimace alternativu ke konvenční krystalizaci; Krystaly již nebudou syntetizovány z roztoku, ale prostřednictvím co nejkontrolovanějšího ukládání par na chladném povrchu, kde mohou být vhodně krystalická semena, která upřednostňují konkrétní morfologii.
Řekněme, že pokud máte červené čtverce, růst krystalů si udrží tuto geometrii a neměly by se stát trojúhelníkovými. Jak sublimace probíhá, červené čtverečky budou postupně růst. Jedná se však o provozně a molekulárně složitý komplex, ve kterém je zahrnuto mnoho proměnných..
Příklady krystalů syntetizovaných sublimací jsou: karbid křemíku (SiC), grafit, arsen, selen, fosfor, nitrid hliníku (AlN), sulfid kademnatý (CdS), selenid zinečnatý (ZnSe), jodid rtuťnatý (HgI).dva), grafen, mezi ostatními.
Všimněte si, že se skutečně jedná o dva propletené jevy: progresivní sublimace a depozice (nebo inverzní sublimace); pára migruje z pevné látky do chladnějších oblastí nebo povrchů a nakonec se usazuje ve formě krystalů.
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2019). Sublimace (fázový přechod). Obnoveno z: en.wikipedia.org
- Jones, Andrew Zimmerman. (27. ledna 2019). Sublimace. Obnoveno z: thoughtco.com
- Sheila Morrissey. (2019). Co je sublimace v chemii? - Definice, proces a příklady. Studie. Obnoveno z: study.com
- Elsevier B.V. (2019). Sublimační metoda. ScienceDirect. Obnoveno z: sciencedirect.com



Zatím žádné komentáře