
Struktura síranu železitého, vlastnosti, rizika a použití

The síran železitý, síran železitý, Mars vitriol nebo marťanská caparrosa je anorganická sloučenina vzorce Fedva(SO4)3. Každý atom železa má tři iontové vazby se síranem.
Síran železitý se nachází v široké škále minerálů, zejména v minerálech pyrit a marcasit, kde je síran železnatý spojen s oxidem železitým (Fe0).
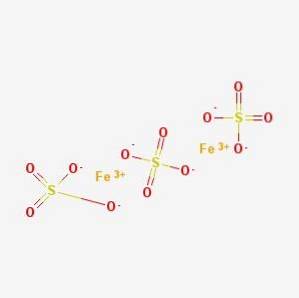
Další minerály, jako je coquimbit, kornelit a lausenit, jsou zdrojem síranu železitého nona, hepty a pentahydrátu. Na druhou stranu jej lze nalézt v minerálech, jako je Mikasita, kde tvoří směs s hliníkem (síran železitý, 2005-2017).
Síran železitý se většinou extrahuje z přírody, lze ho však také připravit odpařením oxidu železitého a kyseliny sírové. Obecně se připravuje zpracováním síranu železnatého a oxidačního činidla s kyselinou sírovou při zvýšených teplotách následujícím způsobem:
2FeSO4 + HdvaSW4 + HdvaNEBOdva → Víradva(SW4)3 + 2HdvaNEBO
Roztoky síranu železitého se připravují vstřikováním plynného chloru do roztoku síranu železnatého.
Ve vodném roztoku Fedva (SW4)3 disociuje na ionty Fe3+ (aq) a SO4dva- (aq). Síranové ionty budou solvatovány vodíkovými vazbami s vodou a ionty železa vytvoří hexahydrátový komplex (III), [Fe (H2O) 6]3+ (Co se stane se síranem železitým (síran železitý) ve vodném roztoku?, 2015).
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 Reaktivita a nebezpečí
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti
Síran železitý je hygroskopická pevná látka, jejíž vzhled a aroma se mohou lišit v závislosti na množství vody obsažené v soli..
Nejběžnějšími formami, ve kterých se v přírodě nachází síran železnatý, jsou hydratovaná penta a žádná. V takovém případě mohou mít krystaly této sloučeniny žlutou barvu. Když je v bezvodé formě, má šedou barvu (síran železitý, 2016).

Molekuly síranu železitého tvoří kosočtverečné nebo kosočtverečné krystaly. Jeho bezvodá forma má molekulovou hmotnost 399,858 g / mol, její hydratovaná penta a žádná forma nemá molekulovou hmotnost 489,960 g / mol, respektive 562 000 g / mol (Royal Society of Chemistry, 2015).
Jeho hustota je 3,097 g / ml (bezvodý) a jeho teplota tání je 480 ° C (bezvodý) a 175 ° C (bez hydratace). Je málo rozpustný ve vodě a alkoholu, zatímco velmi těžce rozpustný v acetonu a ethylacetátu a nerozpustný v kyselině sírové (National Center for Biotechnology Information, S.F.).
Síran železa III je kyselý a je korozivní pro měď, slitiny mědi, měkkou ocel a pozinkovanou ocel (FERRIC SULFATE, 2016).
Reaktivita a nebezpečí
Síran železitý je stabilní nehořlavá sloučenina, po zahřátí však emituje toxické páry železa a oxidů síry..
Je velmi nebezpečný při požití, kontaktu s pokožkou a očima (dráždivý) a vdechování. Látka je toxická pro plíce a sliznice a opakované nebo dlouhodobé vystavení látce může způsobit poškození těchto orgánů..
V případě kontaktu s očima je třeba kontaktní čočky zkontrolovat a vyjmout. Oční mast by se neměla používat a je třeba vyhledat lékařskou pomoc..
V případě kontaktu s pokožkou je třeba ji okamžitě jemným způsobem umýt velkým množstvím vody a dbát na to, aby nedošlo k použití neabrazivního mýdla. Podrážděnou pokožku zakryjte změkčovadlem, pokud podráždění přetrvává, vyhledejte lékařskou pomoc.
Pokud je kontakt s pokožkou silný, měl by být omyt dezinfekčním mýdlem a kontaminovanou pokožku překrýt antibakteriálním krémem. Vyhledejte lékařskou pomoc.
V případě vdechnutí by měl být postižený ponechán v klidu na dobře větraném místě a okamžitě vyhledat lékařskou pomoc..
Při požití nevyvolávejte zvracení, ale uvolněte těsné oblečení, jako je límeček košile, kravata nebo opasek. Pokud oběť nedýchá, měla by být provedena resuscitace z úst do úst. Stejně jako v předchozích případech je třeba okamžitě vyhledat lékařskou pomoc..
Tento typ sloučeniny nevyžaduje konkrétní typ skladování. Používají se dostatečně silné police nebo skříňky, které unesou hmotnost chemikálie, aby bylo zajištěno, že není nutné se napínat, aby se dostaly k materiálům, a aby police nebyly přetíženy (Bezpečnostní list materiálu, síran železitý, 2013).
Aplikace
Síran železitý se používá v průmyslu, při úpravě vody a čištění odpadních vod díky své schopnosti flokulantu a koagulantu a eliminovat zápach sloučenin síry..
Síran železitý se používá jako pevné separační činidlo a oxidační činidlo. Kromě toho se tato sůl používá v pigmentovém průmyslu a v medicíně, může být použita jako adstringentní a styptická.
V práci Ibricevic (2000) bylo u dětí ve věku 3 až 6 let (hlavní věk: 4,3 let) léčených konvenční pulpotomií ošetřeno 70 exponovaných karyózních primárních molárních zubů bez příznaků a bez známek resorpce kořene..
Jako pulpotomická činidla použili 15,5% roztok síranu železitého (aplikovaný po dobu 15 sekund na 35 zubů) a roztok formokrezolu (5minutový postup podle Buckleyho vzorce pro dalších 35 zubů)..
V obou skupinách byly pařezy pokryty pastou z oxidu zinečnatého eugenolu. Trvalými výplněmi byly korunky z nerezové oceli. Klinická kontrola byla každé tři měsíce a rentgenové sledování bylo šest a dvacet měsíců po léčbě..
Výsledky v tomto období odhalily 100% klinickou úspěšnost v obou skupinách. Radiografická úspěšnost byla v obou skupinách 97,2%, zatímco u 2,8% vykazovaly případy vnitřní resorpci kořenů.
Síran železitý a jarosit byly detekovány dvěma marťanskými Rovers Spirit a Opportunity. Tyto látky svědčí o vysoce oxidačních podmínkách převládajících na povrchu Marsu..
Reference
- Síran železitý. (2016). Obnoveno z chemické knihy: chemicalbook.com.
- FERRIC SULFATE. (2016). Citováno z cameochemicals: cameochemicals.noaa.gov.
- Síran železitý vzorec. (2005-2017). Citováno z softschools: softschools.com.
- Ibricevic H1, a.-J. Q. (2000). Síran železitý jako prostředek pulpotomie v primárních zubech: dvacetiměsíční klinické sledování. Clin Pediatr Dent 24 (4), 269-272.
- Bezpečnostní list materiálu Síran železitý. (2013, 21. května). Citováno z sciencelab.
- Národní centrum pro biotechnologické informace. (S.F.). Složená databáze PubChem; CID = 24826. Citováno z PubChem.
- Royal Society of Chemistry. (2015). Síran železitý. Obnoveno z chemspidera.
- Co se stane se síranem železnatým ve vodném roztoku? (2015, 8. srpna). Citováno z stackexchange: stackexchange.com.


Zatím žádné komentáře