
Periodická tabulka historie prvků, struktura, prvky

The periodická tabulka prvků je nástroj, který vám umožní konzultovat chemické vlastnosti dosud známých 118 prvků. Je to nezbytné při provádění stechiometrických výpočtů, předpovídání fyzikálních vlastností prvku, jejich klasifikace a hledání periodických vlastností mezi všemi..
Atomy se stávají těžšími, protože jejich jádra přidávají protony a neutrony, které musí být také doprovázeny novými elektrony; jinak by elektroneutralita nebyla možná. Některé atomy jsou tedy velmi lehké, například vodík, a jiné velmi těžké, například oganeson.
Komu patří takové srdce za chemii? Vědci Dmitriji Mendělejevovi, který v roce 1869 (před téměř 150 lety) zveřejnil po deseti letech teoretických studií a experimentů první periodickou tabulku ve snaze uspořádat 62 tehdy známých prvků.
Za tímto účelem se Mendělejev spoléhal na chemické vlastnosti, zatímco Lothar Meyer současně publikoval další periodickou tabulku, která byla uspořádána podle fyzikálních vlastností prvků..
Tabulka původně obsahovala „prázdná místa“, jejichž prvky nebyly v těchto letech známy. Mendělejev však dokázal předpovědět několik svých vlastností se znatelnou přesností. Některé z těchto prvků byly: germanium (které nazval eka-křemík) a gallium (eka-hliník).
První periodické tabulky uspořádaly prvky podle jejich atomových hmot. Toto uspořádání odhalilo určitou periodicitu (opakování a podobnost) chemických vlastností prvků; přechodové prvky však s tímto řádem nesouhlasily a ani vzácné plyny.
Z tohoto důvodu bylo nutné místo atomové hmotnosti objednat prvky s ohledem na atomové číslo (počet protonů). Odtud, spolu s tvrdou prací a příspěvky mnoha autorů, byla Mendělejevova periodická tabulka vylepšena a dokončena..
Rejstřík článků
- 1 Historie periodické tabulky
- 1.1 Prvky
- 1.2 Symbologie
- 1.3 Vývoj schématu
- 1.4 Telluric šroub Chancourtois (1862)
- 1,5 oktávy Newlands (1865)
- 1.6 Mendělejevův stůl (1869)
- 1.7 Moseleyova periodická tabulka (aktuální periodická tabulka) - 1913
- 2 Jak je organizována? (Struktura a organizace)
- 2.1 Období
- 2.2 Skupiny
- 2.3 Počet protonů vs. valenční elektrony
- 3 Prvky periodické tabulky
- 3.1 Blok s
- 3,2 p blok
- 3.3 Reprezentativní prvky
- 3.4 Přechodné kovy
- 3.5 Vnitřní přechodné kovy
- 3.6 Kovy a nekovy
- 3.7 Kovové rodiny
- 3.8 metaloidy
- 3.9 Plyny
- 4 Použití a aplikace
- 4.1 Predikce vzorců oxidů
- 4.2 Valence prvků
- 4.3 Digitální periodické tabulky
- 5 Důležitost periodické tabulky
- 6 Reference
Historie periodické tabulky
Elementy
Použití prvků jako základu k popisu prostředí (přesněji přírody) se používá od starověku. V té době se však o nich říkalo jako o fázích a stavech hmoty, nikoli o způsobu, jakým se o nich mluví ze středověku.
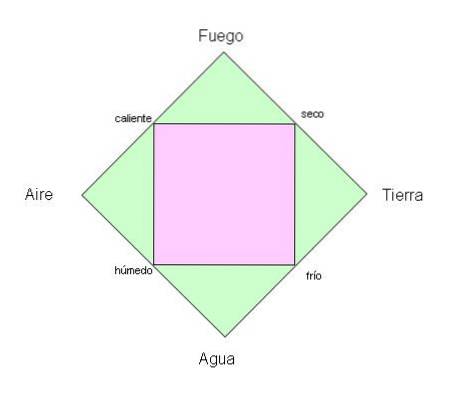
Staří Řekové věřili, že planetu, kterou obýváme, tvoří čtyři základní prvky: oheň, země, voda a vzduch..
Na druhou stranu ve starověké Číně byl počet prvků pět a na rozdíl od Řeků tyto vylučovaly vzduch a zahrnovaly kov a dřevo..

První vědecký objev provedl v roce 1669 německý Henning Brand, který objevil fosfor; k tomuto datu byly zaznamenány všechny následující položky.

Je třeba objasnit, že některé prvky, jako je zlato a měď, byly známy již před fosforem; rozdíl je v tom, že nikdy nebyly zaregistrovány.
Symbologie
Alchymisté (předkové dnešních chemiků) pojmenovali prvky ve vztahu ke konstelacím, jejich objevitelům a místům, kde byly objeveny.
V roce 1808 Dalton navrhl sérii kreseb (symbolů), které představují prvky. Později byl tento notační systém nahrazen systémem Jhon Berzelius (dosud používán), protože Daltonův model se stal komplikovanějším, když se objevily nové prvky..
Vývoj schématu
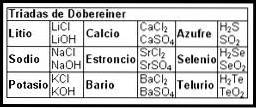
První pokusy o vytvoření mapy, která organizovala informace o chemických prvcích, se objevily v 19. století pomocí Döbereinerových triád (1817).
V průběhu let byly nalezeny nové prvky, které vedly k vzniku nových organizačních modelů, dokud se nepoužívá ten, který se aktuálně používá..
Chancourtois Telluric Screw (1862)
Alexandré-Émile Béguyer de Chancourtois navrhl papírovou šroubovici zobrazující graf spirál (tellurický šroub).
V tomto systému jsou prvky seřazeny ve vzestupném pořadí s ohledem na jejich atomové hmotnosti. Podobné položky jsou svisle zarovnány.
Octaves of Newlands (1865)
V pokračování Döbereinerovy práce uspořádal Brit John Alexander Reina Newlands chemické prvky ve vzestupném pořadí s ohledem na atomové hmotnosti, přičemž poznamenal, že každých sedm prvků mělo podobné vlastnosti (vodík není zahrnut).
Mendělejevův stůl (1869)
Mendělejev uspořádal chemické prvky ve vzrůstajícím pořadí s ohledem na atomovou hmotnost a do stejného sloupce umístil ty, jejichž vlastnosti byly podobné. Zanechal mezery ve svém modelu periodické tabulky a předvídal výskyt nových prvků v budoucnosti (kromě předpovědi vlastností, které by měl mít).
Vzácné plyny se v Mendělejevově tabulce neobjevují, protože ještě nebyly objeveny. Mendeleiv dále neuvažoval o vodíku.
Moseleyho periodická tabulka (aktuální periodická tabulka) - 1913
Henry Gwyn Jeffreys Moseley navrhl uspořádat chemické prvky periodické tabulky podle jejich atomového čísla; tj. v závislosti na počtu protonů.
Moseley vyhlásil „Periodický zákon“ v roce 1913: „Když jsou prvky uspořádány v pořadí podle jejich atomového čísla, jejich fyzikální a chemické vlastnosti vykazují periodické trendy“.
Každý vodorovný řádek nebo období tedy ukazuje jeden typ vztahu a každý sloupec nebo skupina zobrazuje jiný..
Jak je to organizováno? (Struktura a organizace)
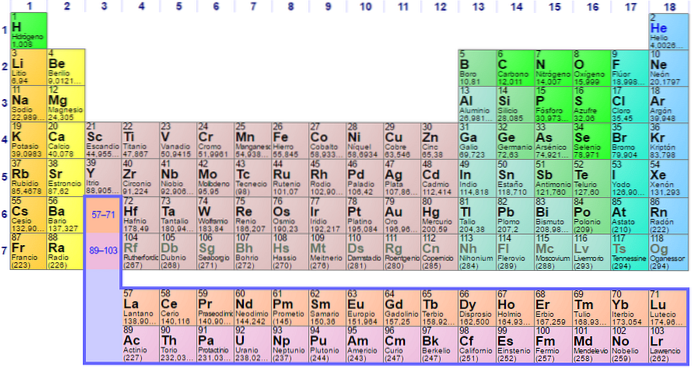
Je vidět, že pastel periodické tabulky má několik barev. Každá barva spojuje prvky s podobnými chemickými vlastnostmi. K dispozici jsou oranžové, žluté, modré, fialové sloupy; zelené čtverce a úhlopříčka zelené jablko.
Všimněte si, že buňky ve středních sloupcích mají šedivou barvu, takže všechny tyto prvky musí mít něco společného, to znamená, že se jedná o přechodné kovy s poloplnými d orbitaly..
Stejným způsobem, prvky fialových čtverců, i když přecházejí z plynných látek, z načervenalé kapaliny na pevnou černo-fialovou (jodovou) a stříbrošedou (astatinovou), jsou to jejich chemické vlastnosti, které z nich dělají kongenery. Tyto vlastnosti jsou řízeny elektronickými strukturami jeho atomů..
Organizace a struktura periodické tabulky není libovolná, ale řídí se řadou periodických vlastností a vzorů hodnot určených pro prvky. Pokud se například kovový znak zmenšuje zleva doprava, nelze očekávat kovový prvek v pravém horním rohu.
Období
Prvky jsou uspořádány v řadách nebo obdobích v závislosti na energetické úrovni jejich orbitalů. Před obdobím 4, kdy se prvky navzájem podařilo zvyšovat pořadí atomové hmotnosti, bylo zjištěno, že u každých osmi z nich se chemické vlastnosti znovu opakovaly (zákon oktáv) Johna Newlandse).
Přechodové kovy byly odlévány s jinými nekovovými prvky, jako je síra a fosfor. Z tohoto důvodu byl vstup kvantové fyziky a elektronových konfigurací zásadní pro pochopení moderních periodických tabulek..
Orbitaly energetické skořápky se při pohybu v období plní elektrony (a jádry protonů a neutronů). Tato energetická vrstva jde ruku v ruce s velikostí nebo atomovým poloměrem; proto jsou prvky horních období menší než ty, které jsou níže.
H a On jsou v první (periodě) energetické úrovni; první řada šedivých čtverců ve čtvrtém období; a řada oranžových čtverců v šesté periodě. Všimněte si, že i když se zdá, že je to v předpokládané deváté periodě, ve skutečnosti patří do šesté, hned po žluté krabici Ba.
Skupiny
Při procházení obdobím se zjistí, že se zvyšuje hmotnost, počet protonů a elektronů. Ve stejné koloně nebo skupině, i když se hmotnost a protony liší, počet valenční skořepinové elektrony je stejný.
Například v prvním sloupci nebo skupině má H jediný elektron na orbitalu 1 s1, jako Li (2 s1), sodík (3 s.)1), draslík (4 s.)1) a tak dále, dokud francium (7 s.)1). Toto číslo 1 označuje, že tyto prvky stěží mají valenční elektron, a proto patří do skupiny 1 (IA). Každý prvek je v různých obdobích.
Nepočítáme-li vodík se zeleným rámečkem, prvky pod ním jsou oranžově orámované a nazývají se alkalické kovy. Další pole vpravo v kterémkoli období je skupina nebo sloupec 2; to znamená, že jeho prvky mají dva valenční elektrony.
Ale když se posuneme o krok dále doprava, bez znalosti orbitalů d, dojde k bórové skupině (B) nebo skupině 13 (IIIA); místo skupiny 3 (IIIB) nebo skandia (Sc). Vezmeme-li v úvahu naplnění d orbitalů, začneme procházet obdobími šedivých čtverců: přechodnými kovy.
Počet protonů vs. valenční elektrony
Při studiu periodické tabulky může dojít k záměně mezi atomovým číslem Z nebo počtem celkových protonů v jádru a počtem valenčních elektronů. Například uhlík má Z = 6, to znamená, že má šest protonů a tedy šest elektronů (jinak by to nemohl být neutrálně nabitý atom).
Ale z těch šesti elektronů, čtyři jsou z Valencie. Z tohoto důvodu je jeho elektronová konfigurace [He] 2sdva2 strdva. [He] označuje dva elektrony 1 sdva uzavřené vrstvy a teoreticky se nepodílejí na tvorbě chemických vazeb.
Protože uhlík má čtyři valenční elektrony, nachází se „pohodlně“ ve skupině 14 (IVA) periodické tabulky..
Prvky pod uhlíkem (Si, Ge, Sn, Pb a Fl) mají vyšší atomová čísla (a atomové hmotnosti); ale všechny mají společné čtyři valenční elektrony. To je klíč k pochopení toho, proč prvek patří do jedné skupiny a ne do jiné..
Prvky periodické tabulky
Block s
Jak bylo právě vysvětleno, skupiny 1 a 2 jsou charakterizovány tím, že mají jeden nebo dva elektrony na s orbitálech. Tyto orbitaly mají sférickou geometrii a při sestupu skrz kteroukoli z těchto skupin získávají prvky vrstvy, které zvětšují velikost jejich atomů..
Protože tyto prvky mají silné tendence ve svých chemických vlastnostech a způsobech reakce, jsou tyto prvky organizovány jako blok s. Proto do tohoto bloku patří alkalické kovy a kovy alkalických zemin. Konfigurace elektronů prvků tohoto bloku je ns (1s, 2s atd.).
Ačkoli je prvek helium v pravém horním rohu tabulky, jeho elektronová konfigurace je 1 sdva a proto patří do tohoto bloku.
Blokovat p
Na rozdíl od s bloku mají prvky tohoto bloku zcela vyplněné s orbitaly, zatímco jejich p orbitaly jsou i nadále vyplňovány elektrony. Elektronické konfigurace prvků patřících do tohoto bloku jsou typu nsdvanp1-6 (P orbitaly mohou mít jeden nebo až šest elektronů k naplnění).
Takže kde na periodické tabulce je tento blok umístěn? Vpravo: zelené, fialové a modré čtverce; tj. nekovové prvky a těžké kovy, jako je vizmut (Bi) a olovo (Pb).
Počínaje bórem, s elektronovou konfigurací nsdvanp1, uhlík napravo přidává další elektron: 2 sdva2 strdva. Dále jsou elektronové konfigurace ostatních prvků periody 2 bloku p: 2sdva2 str3 (dusík), 2 sdva2 str4 (kyslík), 2 sdva2 str5 (fluor) a 2 sdva2 str6 (neon).
Pokud sestoupíte do nižších období, budete mít energetickou hladinu 3: 3 sdva3p1-6, a tak dále až do konce bloku p.
Všimněte si, že nejdůležitější věcí na tomto bloku je, že od 4. období mají jeho prvky zcela vyplněné d orbitaly (modré rámečky vpravo). Stručně řečeno: blok s je na levé straně periodické tabulky a blok p na pravé straně.
Reprezentativní prvky
Jaké jsou reprezentativní prvky? Jsou to ti, kteří na jedné straně snadno ztratí elektrony, nebo na druhé straně je získají k dokončení oktetu valence. Jinými slovy: jsou to prvky bloků s a p.
Jejich skupiny se od ostatních odlišovaly písmenem A na konci. Existovalo tedy osm skupin: od IA po VIIIA. V současné době je ale systém číslování používaný v moderních periodických tabulkách arabský, od 1 do 18, včetně přechodných kovů..
Z tohoto důvodu může být skupina boru IIIA nebo 13 (3 + 10); uhlíková skupina, DPH nebo 14; a ten z ušlechtilých plynů, poslední na pravé straně stolu, VIIIA nebo 18.
Přechodné kovy
Přechodové kovy jsou všechny prvky šedivých čtverců. Po celou dobu jejich období jsou vyplněny jejich d orbitaly, což je pět, a proto mohou mít deset elektronů. Protože musí mít deset elektronů k vyplnění těchto orbitalů, musí existovat deset skupin nebo sloupců.
Každá z těchto skupin ve starém systému číslování byla označena římskými číslicemi a písmenem B na konci. První skupina, skandium, byla IIIB (3), skupina železa, kobaltu a niklu VIIIB pro velmi podobné reaktivity (8, 9 a 10) a skupina zinku IIB (12).
Jak je vidět, je mnohem snazší rozpoznat skupiny podle arabských čísel než podle římských číslic..
Vnitřní přechodové kovy
Od 6. období periodické tabulky se f orbitaly stanou energeticky dostupnými. Ty musí být vyplněny jako první než d orbitaly; a proto jsou jeho prvky obvykle umístěny od sebe, aby příliš neroztahovaly stůl.
Poslední dvě období, oranžová a šedá, jsou vnitřní přechodné kovy, nazývané také lanthanoidy (vzácné zeminy) a aktinidy. Existuje sedm f orbitalů, které k naplnění potřebují čtrnáct elektronů, a proto musí existovat čtrnáct skupin.
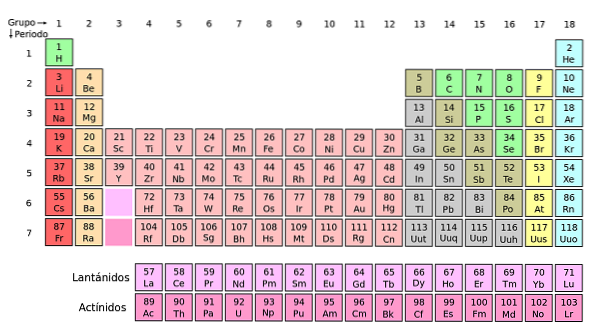
Pokud jsou tyto skupiny přidány do periodické tabulky, bude jich celkem 32 (18 + 14) a bude existovat „dlouhá“ verze:
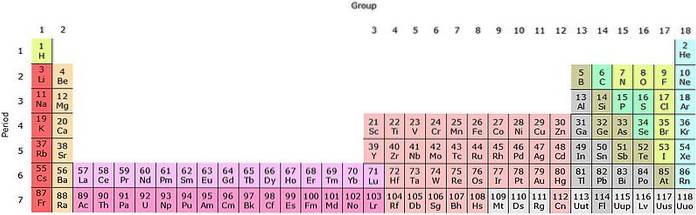
Světle růžová řada odpovídá lanthanoidům, zatímco tmavě růžová řada odpovídá aktinoidům. Lanthan, La se Z = 57, aktinium, Ac se Z = 89 a celý f blok patří do stejné skupiny jako skandium. Proč? Protože skandium má druhou orbitál1, který je přítomen ve zbytku lanthanoidů a aktinoidů.
La a Ac mají nastavení 5d valence16 sdva a 6d17 sdva. Jak se pohybujete doprava přes oba řádky, začnou se vyplňovat orbitaly 4f a 5f. Po naplnění se dostanete k prvkům lutetium, Lu a laurencio, Lr.
Kovy a nekovy
Ponecháme-li koláč periodické tabulky, je pohodlnější uchýlit se k obrázku na horním obrázku, a to i v jeho podlouhlé formě. V současné době jsou drtivou většinou zmíněných prvků kovy.
Při pokojové teplotě jsou všechny kovy pevné látky (kromě rtuti, která je kapalná) se stříbřitě šedou barvou (kromě mědi a zlata). Také mají tendenci být tvrdé a lesklé; i když bloky bloku s jsou měkké a křehké. Tyto prvky se vyznačují snadnou ztrátou elektronů a tvorbou kationtů M+.
V případě lanthanoidů ztrácejí všechny tři 5d elektrony16 sdva stát se trojmocnými kationty M3+ (jako ona3+). Cer je sám o sobě schopen ztratit čtyři elektrony (Ce4+).
Na druhou stranu nekovové prvky tvoří nejmenší část periodické tabulky. Jsou to plyny nebo pevné látky s kovalentně vázanými atomy (jako je síra a fosfor). Všechny jsou umístěny v bloku p; přesněji v jeho horní části, protože sestup do nižších období zvyšuje kovový charakter (Bi, Pb, Po).
Také nekovy místo ztráty elektronů je získáte. Tvoří tedy anionty X- s různými zápornými náboji: -1 pro halogeny (skupina 17) a -2 pro chalkogeny (skupina 16, kyslík).
Kovové rodiny
V kovech existuje vnitřní klasifikace, která je odlišuje od sebe navzájem:
-Kovy skupiny 1 jsou zásadité
-Skupina 2, kovy alkalických zemin (pan Becambara)
-Skupina skandia skupiny 3 (IIIB). Tato rodina se skládá ze skandia, vedoucí skupiny, yttria Y, lanthanu, aktinia a všech lanthanoidů a aktinoidů.
-Skupina 4 (IVB), skupina titanu: Ti, Zr (zirkonium), Hf (hafnium) a Rf (rutherfordium). Kolik valenčních elektronů mají? Odpověď je ve vaší skupině.
-Skupina 5 (VB), rodina vanadu. Skupina 6 (VIB), skupina chromu. A tak dále až do rodiny zinku, skupina 12 (IIB).
Metaloidy
Kovový znak se zvyšuje zprava doleva a shora dolů. Jaká je ale hranice mezi těmito dvěma typy chemických prvků? Tato hranice se skládá z prvků známých jako metaloidy, které mají vlastnosti kovů i nekovů..
Metalloidy lze vidět na periodické tabulce v „žebříku“, který začíná bórem a končí radioaktivním prvkem astatin. Jedná se o tyto prvky:
-B: bór
-Křemík: Ano
-Ge: germanium
-Jako: arsen
-Sb: antimon
-Te: tellur
-At: astat
Každý z těchto sedmi prvků vykazuje přechodné vlastnosti, které se mění podle chemického prostředí nebo teploty. Jednou z těchto vlastností je polovodič, to znamená, že metaloidy jsou polovodiče.
Plyny
V suchozemských podmínkách jsou plynnými prvky nelehké kovy, jako je dusík, kyslík a fluor. Do této klasifikace spadají také chlór, vodík a ušlechtilé plyny. Ze všech jsou nejtypičtější vzácné plyny kvůli jejich nízké tendenci reagovat a chovat se jako volné atomy..
Ty se nacházejí ve skupině 18 periodické tabulky a jsou:
-Helium, He
-Neon, Ne
-Argon, Ar
-krypton, Kr
-Xenon, Xe
-Radon, Rn
-A nejnovější ze všech, oganeson ze syntetického vzácného plynu, Og.
Všechny vzácné plyny mají společnou valenční konfiguraci nsdvanp6; to znamená, že mají úplný valenční oktet.
Stavy agregace prvků při jiných teplotách
Prvky jsou v pevném, kapalném nebo plynném stavu v závislosti na teplotě a síle jejich interakcí. Pokud by se teplota Země ochladila na absolutní nulu (0K), pak by všechny prvky zmrzly; kromě helia, které by kondenzovalo.
Při této extrémní teplotě by zbytek plynů měl formu ledu.
Na druhém konci, pokud by teplota byla přibližně 6000 K, „všechny“ prvky by byly v plynném stavu. Za těchto podmínek můžete doslova vidět mraky zlata, stříbra, olova a dalších kovů.
Použití a aplikace
Periodická tabulka sama o sobě vždy byla a bude, nástrojem pro prohlížení symbolů, atomových hmot, struktur a dalších vlastností prvků. Je to mimořádně užitečné při provádění stechiometrických výpočtů, které jsou na denním pořádku při mnoha úkolech uvnitř i vně laboratoře.
Nejen to, ale také periodická tabulka vám umožňuje porovnat prvky stejné skupiny nebo období. Lze tedy předvídat, jaké budou určité sloučeniny prvků.
Predikce vzorců oxidů
Například pro oxidy alkalických kovů, protože mají jediný valenční elektron, a proto valenci +1, se očekává, že vzorec jejich oxidů bude typu MdvaO. Zkontroluje se to pomocí vodíku, vody, HdvaO. Také s oxidy sodnými, NadvaO a draslík, K.dvaNEBO.
Pro ostatní skupiny musí mít jejich oxidy obecný vzorec M.dvaNEBOn, kde n se rovná číslu skupiny (pokud je prvek z bloku p, počítá se n-10). Uhlík, který patří do skupiny 14, tedy tvoří COdva (CdvaNEBO4/dva); síra, ze skupiny 16, SO3 (S.dvaNEBO6/dva); a dusík, skupina 15, NdvaNEBO5.
To však neplatí pro přechodné kovy. Je to proto, že železo, i když patří do skupiny 8, nemůže ztratit 8 elektronů, ale 2 nebo 3. Proto je namísto zapamatování vzorců důležitější věnovat pozornost valencím každého prvku..
Valence prvků
Periodické tabulky (některé) ukazují možné valence pro každý prvek. S těmito znalostmi lze předem odhadnout nomenklaturu sloučeniny a její chemický vzorec. Valence, jak již bylo zmíněno dříve, souvisí s číslem skupiny; i když to neplatí pro všechny skupiny.
Valence závisí více na elektronické struktuře atomů a na tom, které elektrony mohou skutečně ztratit nebo získat..
Znalostí počtu valenčních elektronů můžete z této informace také začít s Lewisovou strukturou sloučeniny. Periodická tabulka proto umožňuje studentům a odborníkům načrtnout struktury a ustoupit zkoumání možných geometrií a molekulárních struktur..
Digitální periodické tabulky
Technologie dnes umožnila, aby byly periodické tabulky univerzálnější a poskytovaly více informací dostupným všem. Několik z nich přináší nápadné ilustrace každého prvku a také stručné shrnutí jeho hlavních použití.
Způsob, jakým s nimi komunikujete, zrychluje vaše porozumění a studium. Periodická tabulka by měla být nástrojem, který je oku příjemný, snadno prozkoumatelný a nejúčinnější metodou, jak poznat jeho chemické prvky, je procházet z období do skupin..
Důležitost periodické tabulky
Dnes je periodická tabulka nejdůležitějším organizačním nástrojem v chemii díky podrobným vztahům jejích prvků. Jeho použití je zásadní jak pro studenty a učitele, tak pro výzkumné pracovníky a mnoho odborníků zabývajících se chemickým a inženýrským oborem..
Pouhým pohledem na periodickou tabulku získáte rychle a efektivně obrovské množství a informace, například:
- Lithium (Li), berylium (Be) a bór (B) vedou elektřinu.
- Lithium je alkalický kov, berylium je kov alkalických zemin a bór je nekov.
- Lithium je nejlepší dirigent ze tří jmenovaných, následuje berylium a nakonec bór (polovodič).
Umístěním těchto prvků v periodické tabulce lze tedy okamžitě uzavřít jejich tendenci k elektrické vodivosti..
Reference
- Scerri, E. (2007). Periodická tabulka: její příběh a jeho význam. Oxford New York: Oxford University Press.
- Scerri, E. (2011). Periodická tabulka: velmi krátký úvod. Oxford New York: Oxford University Press.
- Moore, J. (2003). Chemie pro figuríny. New York, NY: Wiley Pub.
- Venable, F.P… (1896). Vývoj periodického zákona. Easton, Pensylvánie: Chemical Publishing Company.
- Ball, P. (2002). Ingredience: prohlídka prvků s průvodcem. Oxford New York: Oxford University Press.
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). Učení CENGAGE.
- Royal Society of Chemistry. (2018). Periodická tabulka. Obnoveno z: rsc.org
- Richard C. Banks. (Leden 2001). Periodická tabulka. Obnoveno z: chemistry.boisestate.edu
- Fyzika 2000. (s.f.). Počátek periodické tabulky. Obnoveno z: physics.bk.psu.edu
- King K. & Nazarewicz W. (7. června 2018). Existuje konec periodické tabulky? Obnoveno z: msutoday.msu.edu
- Dr. Doug Stewart. (2018). Periodická tabulka. Obnoveno z: chemicool.com
- Mendez A. (16. dubna 2010). Mendělejevova periodická tabulka. Obnoveno z: quimica.laguia2000.com


Zatím žádné komentáře