
Příčiny povrchového napětí, příklady, aplikace a experimenty
The povrchové napětí Jedná se o fyzikální vlastnost, kterou všechny kapaliny obsahují, a je charakterizována odolností, kterou jejich povrchy staví proti jakémukoli zvětšení jejich plochy. To je stejné jako říkat, že uvedená plocha bude hledat co nejmenší plochu. Tento jev proplétá několik chemických konceptů, jako je soudržnost, adheze a mezimolekulární síly..
Povrchové napětí je zodpovědné za tvorbu povrchových zakřivení kapalin v trubkových nádobách (odměrné válce, sloupy, zkumavky atd.). Mohou být konkávní (zakřivené ve tvaru údolí) nebo konvexní (zakřivené ve tvaru kopule). Mnoho fyzikálních jevů lze vysvětlit zvážením změn, kterými prochází povrchové napětí kapaliny..

Jedním z těchto jevů je tendence kapalných molekul hromadit se ve formě kapek, když spočívají na površích, které je odpuzují. Například kapky vody, které vidíme na listech, ji nemohou namočit kvůli voskovitému, hydrofobnímu povrchu..
Přijde však čas, kdy gravitace hraje svoji roli a kapka se rozlije jako sloupec vody. Podobný jev nastává u sférických kapek rtuti při rozlití z teploměru.
Na druhou stranu je povrchové napětí vody nejdůležitější ze všech, protože přispívá a organizuje stav mikroskopických těl ve vodných médiích, jako jsou buňky a jejich lipidové membrány. Toto napětí je navíc zodpovědné za to, že se voda pomalu odpařuje a některá tělesa jsou hustší, než mohou plavat na svém povrchu..
Rejstřík článků
- 1 Příčiny povrchového napětí
- 2 jednotky
- 3 Povrchové napětí vody
- 4 Další příklady
- 4.1 Kondenzované plyny
- 4.2 Nepolární kapaliny
- 4.3 Polární kapaliny
- 5 Aplikace
- 5.1 Čisticí prostředky
- 5.2 Emulze
- 6 jednoduchých experimentů
- 6.1 Clip experiment
- 6.2 Papírový člun
- 7 Reference
Příčiny povrchového napětí
Vysvětlení fenoménu povrchového napětí je na molekulární úrovni. Molekuly kapaliny interagují navzájem takovým způsobem, že jsou soudržné ve svých nepravidelných pohybech. Molekula interaguje se svými sousedy vedle a s těmi nad nebo pod ní.
To se však neděje stejně u molekul na povrchu kapaliny, které jsou ve styku se vzduchem (nebo jiným plynem), nebo s pevnou látkou. Molekuly na povrchu nemohou být soudržné s molekulami vnějšího prostředí.
Ve výsledku nezažijí žádné síly, které by je táhly nahoru; pouze dolů, od sousedů v kapalném médiu. Aby se vyrovnalo s touto nerovnováhou, povrchové molekuly „sevřely“, protože jen tak mohou překonat sílu, která je tlačí dolů.
Poté se vytvoří povrch, kde jsou molekuly v napjatějším uspořádání. Pokud chce částice proniknout do kapaliny, musí nejprve projít tuto molekulární bariéru úměrně s povrchovým napětím uvedené kapaliny. Totéž platí pro částici, která chce uniknout do vnějšího prostředí z hlubin kapaliny..
Jeho povrch se proto chová, jako by to byl elastický film, který vykazuje odolnost proti deformaci..
Jednotky
Povrchové napětí je obvykle reprezentováno symbolem γ a je vyjádřeno v jednotkách N / m, síla krát délka. Většinou však jeho jednotkou je dyn / cm. Jeden lze převést na druhý následujícím konverzním faktorem:
1 dyn / cm = 0,001 N / m
Povrchové napětí vody
Voda je nejvzácnější a nejúžasnější ze všech kapalin. Jeho povrchové napětí, stejně jako několik jeho vlastností, jsou neobvykle vysoké: 72 dyn / cm při pokojové teplotě. Tato hodnota se může zvýšit na 75,64 dyn / cm při teplotě 0 ° C; nebo snížit na 58,85 ° C, při teplotě 100 ° C.
Tato pozorování dávají smysl, když uvážíte, že molekulární bariéra se ještě více utahuje při teplotách blízkých bodu mrazu, nebo se „uvolňuje“ o něco více kolem bodu varu..
Voda má vysoké povrchové napětí díky vodíkovým vazbám. Pokud jsou samy o sobě v kapalině patrné, jsou ještě více na povrchu. Molekuly vody jsou silně zapletené a vytvářejí interakce dipól-dipól typu H.dvaOH OH.

Taková je účinnost jejich interakcí, že vodná molekulární bariéra může dokonce podporovat některá těla, než se potopí. V částech aplikace a experimenty bude tento bod znovu použit.
Další příklady
Všechny kapaliny vykazují povrchové napětí, a to buď v menší či větší míře než voda, nebo ať už jde o čisté látky nebo roztoky. Jak silné a napjaté jsou molekulární bariéry jejích povrchů, bude přímo záviset na jejich intermolekulárních interakcích, jakož i na strukturálních a energetických faktorech..
Kondenzované plyny
Například molekuly plynů v kapalném stavu vzájemně interagují pouze prostřednictvím londýnských disperzních sil. To odpovídá skutečnosti, že jejich povrchové napětí má nízké hodnoty:
-Kapalné hélium, 0,37 dyn / cm při -273 ° C
-Kapalný dusík, 8,85 dyn / cm při -196 ° C
-Kapalný kyslík, 13,2 dyn / cm při -182 ° C
Povrchové napětí kapalného kyslíku je vyšší než povrchové napětí hélia, protože jeho molekuly mají větší hmotnost..
Nepolární kapaliny
Očekává se, že nepolární a organické kapaliny budou mít vyšší povrchové napětí než tyto kondenzované plyny. Mezi některými z nich máme následující:
-Diethylether, 17 dyn / cm při 20 ° C
-n-Hexan, 18,40 dyn / cm při 20 ° C
-n-Oktan, 21,80 dyn / cm při 20 ° C
-Toluen, 27,73 dyn / cm při 25 ° C
Podobný trend je pozorován u těchto kapalin: povrchové napětí se zvyšuje se zvyšováním jejich molekulových hmot. Nicméně n-Podle toho by měl mít oktan nejvyšší povrchové napětí a ne toluen. Zde vstupují do hry molekulární struktury a geometrie.
Molekuly toluenu, ploché a kruhové, mají účinnější interakce než ty n-oktan. Proto je povrch toluenu "těsnější" než povrch n-oktan.
Polární kapaliny
Jelikož mezi molekulami polární kapaliny existují silnější interakce dipól-dipól, mají tendenci vykazovat vyšší povrchové napětí. Ale není tomu tak vždy. Mezi příklady patří:
-Kyselina octová, 27,60 dyn / cm při 20 ° C
-Aceton, 23,70 dyn / cm při 20 ° C
-Krev, 55,89 dyn / cm při 22 ° C
-Ethanol, 22,27 dyn / cm při 20 ° C
-Glycerol, 63 dyn / cm při 20 ° C
-Roztavený chlorid sodný, 163 dyn / cm při 650 ° C
-6 M roztok NaCl, 82,55 dyn / cm při 20 ° C
Předpokládá se, že roztavený chlorid sodný má obrovské povrchové napětí: je to viskózní iontová kapalina..
Na druhou stranu je rtuť jednou z kapalin s nejvyšším povrchovým napětím: 487 dyn / cm. V něm je jeho povrch složen ze silně soudržných atomů rtuti, mnohem více, než mohou být molekuly vody..
Aplikace

Samotné povrchové napětí nemá žádné aplikace. To však neznamená, že není zapojen do různých denních jevů, které by, pokud by neexistovaly, nenastaly..
Například komáři a jiný hmyz jsou schopni procházet vodou. Je to proto, že jejich hydrofobní nohy odpuzují vodu, zatímco jejich nízká hmotnost jim umožňuje zůstat na hladině na molekulární bariéře, aniž by spadly na dno řeky, jezera, rybníka atd..
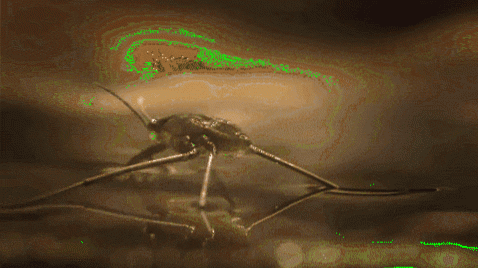
Povrchové napětí také hraje roli ve smáčivosti kapalin. Čím vyšší je jeho povrchové napětí, tím menší je jeho sklon prosakovat póry nebo prasklinami v materiálu. Kromě toho nejsou příliš užitečné kapaliny k čištění povrchů.
Čistící prostředky
Zde působí detergenty, které snižují povrchové napětí vody a pomáhají jí pokrýt větší plochy; a zároveň zlepšuje jeho odmašťovací účinek. Snižováním povrchového napětí vytváří prostor pro molekuly vzduchu, se kterými vytváří bubliny..
Emulze
Na druhé straně nízké vyšší napětí souvisí se stabilizací emulzí, které jsou velmi důležité při formulaci různých sortimentů produktů..
Jednoduché experimenty

Nakonec budou citovány některé experimenty, které lze provést v jakémkoli domácím prostoru..
Clip experiment
Na jeho povrch se ve sklenici studené vody umístí kovová spona. Jak je vidět na obrázku výše, klip zůstane na hladině díky povrchovému napětí vody. Pokud ale do sklenice přidáte trochu kameninové lávy, povrchové napětí dramaticky poklesne a kancelářská svorka se náhle prohne..
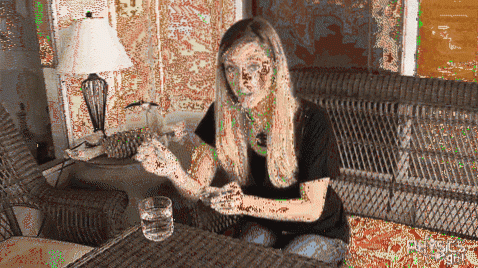
Papírová lodička
Pokud na povrchu máme papírovou loďku nebo dřevěnou paletu a pokud se do hlavy tamponu přidá myčka nebo čisticí prostředek, objeví se zajímavý jev: dojde k odpuzování, které je bude šířit směrem k okrajům sklenka. Papírová loďka a dřevěná paleta se vzdálí od tampónu potřeného čisticím prostředkem.

Další podobný a grafičtější experiment spočívá v opakování stejné operace, ale v kbelíku s vodou posypanou černým pepřem. Částice černého pepře budou odcházet a povrch se změní z pepře pokrytého na křišťálově čistý s pepřem na okrajích.
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2020). Povrchové napětí. Obnoveno z: en.wikipedia.org
- USGS. (s.f.). Povrchové napětí a voda. Obnoveno z: usgs.gov
- Jones, Andrew Zimmerman. (12. února 2020). Povrchové napětí - definice a experimenty. Obnoveno z: thoughtco.com
- Susanna Laurén. (2017, 15. listopadu). Proč je povrchové napětí důležité? Biolin Scientific. Obnoveno z: blog.biolinscientific.com
- Rookie Rodičovství Science. (07. listopadu 2019). Co je to povrchové napětí | Skvělý vědecký experiment. Obnoveno z: rookieparenting.com
- Jessica Munk. (2020). Experimenty s povrchovým napětím. Studie. Obnoveno z: study.com
- Dítě by to mělo vidět. (2020). Sedm experimentů povrchového napětí - Fyzická dívka. Obnoveno z: thekidshouldseethis.com



Zatím žádné komentáře