
Vzorec thiosíranu sodného (Na2S2O3), vlastnosti a použití
The thiosíran sodný nebo hyposulfit sodný (NadvaSdvaNEBO3) Je to důležitá anorganická sůl s různým lékařským využitím. Je také k dispozici ve formě pentahydrátu (NadvaSdvaNEBO3.5HdvaNEBO).
Je to iontová sloučenina tvořená dvěma kationty sodíku (Na+) a záporně nabitý thiosíranový anion (SdvaNEBO3-), ve kterém je centrální atom síry spojen se třemi atomy kyslíku a dalším atomem síry (odtud předpona strýc), prostřednictvím jednoduchých a dvojných vazeb s rezonančním charakterem. Pevná látka existuje v monoklinické krystalové struktuře.
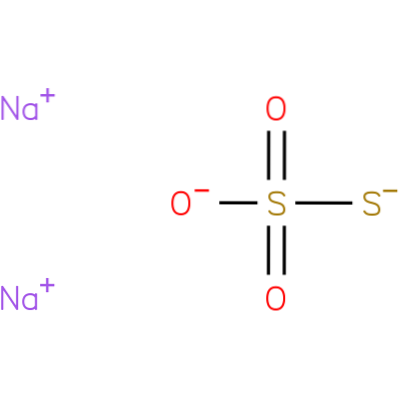
Thiosíran sodný lze připravit zahřátím síry vodným roztokem siřičitanu sodného nebo vodným roztokem hydroxidu sodného..
6NaOH + 4S → NadvaSdvaNEBO3 + 2NadvaS + 3HdvaNEBO
Je to lék, který je na seznamu základních léčivých přípravků Světové zdravotnické organizace, nejúčinnějších a nejbezpečnějších léků, které jsou ve zdravotnictví potřebné (Sodium Thiosulfate Formula, S.F.).
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 Reaktivita a nebezpečí
- 3 použití
- 3.1 Lék
- 3.2 Jodometrie
- 3.3 Dechlorace vody
- 3.4 Těžba zlata
- 4 Odkazy
Fyzikální a chemické vlastnosti
Thiosíran sodný má molekulovou hmotnost 158,11 g / mol pro bezvodou formu a 248,18 g / mol pro pentahydrátovou formu. Kromě toho má hustotu 1667 g / ml (National Center for Biotechnology Information., 2017).
Thiosíran sodný jsou bezbarvé monoklinické krystaly bez charakteristické vůně. Uvedená pevná látka je výkvětová, což znamená, že může být sama vystavena působení prachu ztrátou krystalizační vody při vystavení vzduchu. Jeho vzhled je znázorněn na obrázku 2.

Sloučenina má teplotu tání 48 ° C pro pentahydrátovou formu a od 100 ° C se začíná rozkládat. PakdvaSdvaNEBO3 Je velmi rozpustný ve vodě a je schopen rozpustit 70 gramů na 100 mililitrů rozpouštědla. Sloučenina je prakticky nerozpustná v ethanolu (Royal Society of Chemistry, 2015).
Thiosíran sodný je neutrální sůl, která se snadno disociuje ve vodě za vzniku iontů sodíku a thiosíranu. NadvaSdvaNEBO3 Je to stabilní pevná látka za normálních podmínek, ale při zahřátí se rozkládá za vzniku síranu sodného a polysulfidu sodného:
4NadvaSdvaNEBO3 → 3NadvaSW4 + NadvaS5
Rozkládá se také při působení zředěných kyselin za vzniku síry a oxidu siřičitého (nazývaného hodinová reakce):
NadvaSdvaNEBO3 + 2HCl → 2NaCl + S + SOdva + HdvaNEBO
Reaguje stechiometricky (v ekvimolárních množstvích) s vodnými roztoky jódu, takže je široce používán v laboratořích pro titrace na základě jódu.
Reaktivita a nebezpečí

Thiosíran sodný není toxický materiál a používá se pro lékařské účely. Při rozkladu však vytváří toxické výpary oxidu siřičitého, které mohou způsobit podráždění očí, pokožky a sliznic..
Sloučenina může dráždit oči, kůži a dýchací cesty. Látka je toxická pro plíce a sliznice. Opakovaná nebo dlouhodobá expozice látce může způsobit poškození těchto orgánů..
Dojde-li ke kontaktu sloučeniny s očima, je třeba kontaktní čočky zkontrolovat a vyjmout. Oči by měly být okamžitě proplachovány velkým množstvím vody po dobu nejméně 15 minut studenou vodou.
V případě kontaktu s pokožkou je třeba postižené místo okamžitě opláchnout velkým množstvím vody po dobu nejméně 15 minut a odstranit kontaminovaný oděv a obuv. Podrážděnou pokožku zakryjte změkčovadlem. Před opětovným použitím vyperte oblečení a obuv. Při silném kontaktu omyjte dezinfekčním mýdlem a znečištěnou pokožku překryjte antibakteriálním krémem.
V případě vdechnutí by měl být postižený přemístěn na chladné místo. Pokud nedýchá, je poskytováno umělé dýchání. Pokud je dýchání obtížné, podejte kyslík.
Pokud je sloučenina požita, nemělo by být vyvoláno zvracení, pokud to nenavrhne lékařský personál. Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata.
Ve všech případech je třeba okamžitě vyhledat lékařskou pomoc. (Bezpečnostní list materiálu Bezvodý thiosíran sodný, 2013).
Aplikace
Lék
Thiosíran sodný lze použít ke snížení některých nežádoucích účinků cisplatiny (lék proti rakovině). Používá se při léčbě extravazací během chemoterapie. Thiosíran sodný zabraňuje alkylaci a destrukci tkáně tím, že poskytuje substrát pro alkylační látky, které napadly podkožní tkáně.
Používá se také s jiným lékem při nouzové léčbě otravy kyanidem (US National Library of Medicine, S.F.).
Při tomto ošetření se nitrit sodíku vstřikuje intravenózně za vzniku hemoglobinu, který se kombinuje s kyanidovým iontem a dočasně jej přemění na formu kyanmethoglobinu. Následně se vstřikuje thiosíran sodný.
Thiosíran slouží jako substrát pro enzym rhodanázu, který katalyzuje přeměnu kyanidu na mnohem méně toxický thiokyanát, který se vylučuje močí (HSDB: SODIUM THIOSULFATE, 2003).
Thiosíran sodný se také používá jako léčba kalcipylaxe u lidí na hemodialýze s terminálním onemocněním ledvin. Je zjevně zcela neznámý jev, který u některých pacientů způsobuje těžkou metabolickou acidózu..
Jodometrie
Thiosíran sodný reaguje stechiometricky s jodem za vzniku jodidu podle reakce:
2NadvaSdvaNEBO3 + I2 → S4NEBO62− + 2I-
Tato vlastnost umožňuje sloučeninu použít jako titrant při stanovení jodu..
Toto konkrétní použití lze stanovit pro měření obsahu kyslíku ve vodě prostřednictvím dlouhé řady reakcí ve Winklerově testu na rozpuštěný kyslík..
Používá se také při objemovém odhadu koncentrací určitých sloučenin v roztoku (například peroxidu vodíku) a při odhadu obsahu chloru v komerčních práškových bělících prostředcích a ve vodě..
Dechlorace vody
Thiosíran sodný se používá k dechlorování vody, včetně snižování hladiny chloru pro použití v akváriích, bazénech a lázních a v úpravnách vody k úpravě vody se zpětným proplachem před vypuštěním do řek.
Redukční reakce je analogická s jodovou redukční reakcí, thiosíran redukuje chlornan (aktivní složku v bělidle) a oxiduje na síran. Kompletní reakce je:
4NaClO + NadvaSdvaNEBO3 + 2NaOH → 4NaCl + 2NadvaSW4 + HdvaNEBO
Těžba zlata
Thiosíran sodný je složka používaná jako alternativní loužidlo k kyanidu pro těžbu zlata. S ionty zlata (I) však tvoří silný rozpustný komplex [Au (SdvaNEBO3)dva]3-.
Výhodou tohoto přístupu je, že thiosíran je v podstatě netoxický a že minerální typy, které jsou odolné vůči kyanidaci zlata, mohou být vyluhovány thiosíranem (M.G Aylmore, 2001).
Reference
- EMBL-EBI. (2016, 1. června). thiosíran sodný. Obnoveno z ebi.ac.uk: ebi.ac.uk.
- HSDB: THIOSULFÁT SODNÝ. (2003, 3. května). Obnoveno z toxnetu: toxnet.nlm.nih.gov.
- G Aylmore, D. M. (2001). Vyluhování thiosíranu zlata - recenze. Minerals Engineering Svazek 14, vydání 2, 135-174. sciencedirect.com.
- Bezpečnostní list materiálu Bezvodý thiosíran sodný. (2013, 21. května). Obnoveno z sciencelab.com.
- Národní centrum pro biotechnologické informace… (2017, 18. března). Složená databáze PubChem; CID = 24477. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Thiosíran sodný. Obnoveno z chemspider.com.
- Vzorec thiosíranu sodného. (S.F.). Obnoveno ze softschools: softschools.com.
- S. National Library of Medicine. (S.F.). Thiosíran sodný (do žíly). Obnoveno z ncbi.nlm.nih.gov.



Zatím žádné komentáře