
Přenos, co to je, diagram molekulární energie a cvičení
The propustnost Optický je podíl mezi vznikající intenzitou světla a intenzitou dopadajícího světla na vzorku průsvitného roztoku, který byl osvětlen monochromatickým světlem..
Fyzikální proces průchodu světla vzorkem se nazývá propustnost světla a propustnost je to míra přenosu světla. Propustnost je důležitá hodnota pro stanovení koncentrace vzorku, který je obecně mimo jiné rozpuštěn v rozpouštědle, jako je voda nebo alkohol..
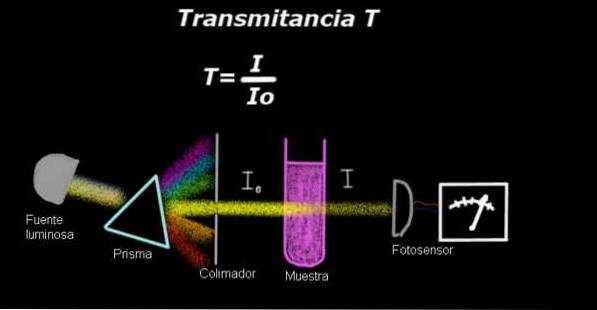
Elektrofotometr měří proud úměrný intenzitě světla, která dopadá na jeho povrch. Pro výpočet propustnosti se obvykle nejprve měří signál intenzity odpovídající samotnému rozpouštědlu a tento výsledek se zaznamená jako Io.
Poté se rozpuštěný vzorek umístí do rozpouštědla za stejných světelných podmínek a signál měřený elektrofotometrem se označí jako Já, pak se propustnost vypočítá podle následujícího vzorce:
T = I / Inebo
Je třeba poznamenat, že propustnost je bezrozměrná veličina, protože se jedná o míru světelné intenzity vzorku ve vztahu k intenzitě přenosu rozpouštědlem..
Rejstřík článků
- 1 Co je propustnost?
- 1.1 Absorpce světla v médiu
- 1.2 Molekulární teorie absorpce světla
- 2 Diagram molekulární energie
- 2.1 Faktory, na kterých závisí propustnost
- 3 Cvičení vyřešeno
- 3.1 Cvičení 1
- 4 Odkazy
Co je propustnost?
Absorpce světla v médiu
Když světlo prochází vzorkem, část světelné energie je absorbována molekulami. Transmitance je makroskopické měřítko jevu, ke kterému dochází na molekulární nebo atomové úrovni.
Světlo je elektromagnetická vlna, energie, kterou přenáší, je v elektrickém a magnetickém poli vlny. Tato oscilační pole interagují s molekulami látky.
Energie přenášená vlnou závisí na její frekvenci. Monochromatické světlo má jednu frekvenci, zatímco bílé světlo má rozsah nebo spektrum frekvencí..
Všechny frekvence elektromagnetických vln se pohybují ve vakuu stejnou rychlostí 300 000 km / s. Pokud označíme C při rychlosti světla ve vakuu frekvenční poměr F a vlnová délka λ to je:
c = λ⋅f
Co C je konstanta na každé frekvenci odpovídá její příslušné vlnové délce.
Pro měření propustnosti látky se používají oblasti viditelného elektromagnetického spektra (380 nm až 780 nm), ultrafialová oblast (180 až 380 nm) a infračervená oblast (780 nm až 5600 nm).
Rychlost šíření světla v materiálovém médiu závisí na frekvenci a je menší než C. To vysvětluje rozptyl v hranolu, kterým lze oddělit frekvence, které tvoří bílé světlo..
Molekulární teorie absorpce světla
Atomy a molekuly kvantovaly energetické hladiny. Při pokojové teplotě jsou molekuly na své nejnižší energetické úrovni.
Foton je kvantová částice spojená s elektromagnetickou vlnou. Energie fotonu je také kvantována, tj. Foton frekvence F má energii danou:
E = h⋅f
kde h je Planckova konstanta, jejíž hodnota je 6,62 × 10 ^ -34 J⋅s.
Monochromatické světlo je paprsek fotonů dané frekvence a energie.
Molekuly absorbují fotony, když se jejich energie shoduje s rozdílem nezbytným k tomu, aby se molekula dostala na vyšší energetickou hladinu.
Přechody energie absorpcí fotonů v molekulách mohou mít několik typů:
1- Elektronické přechody, kdy elektrony molekulárních orbitalů jdou na orbitaly vyšší energie. Tyto přechody se obvykle vyskytují ve viditelném a ultrafialovém rozmezí a jsou nejdůležitější.
2- Vibrační přechody, energie molekulárních vazeb jsou také kvantifikovány a když je foton z infračervené oblasti absorbován, molekula přejde do stavu vyšší vibrační energie.
3 - Rotační přechody, kdy absorpce fotonu vede molekulu do rotačního stavu vyšší energie.
Diagram molekulární energie
Tyto přechody lze nejlépe pochopit pomocí diagramu molekulární energie znázorněného na obrázku 2:
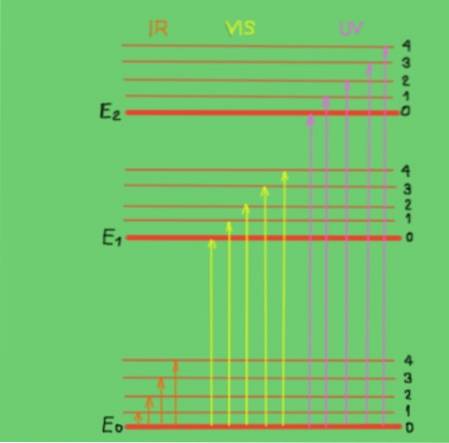
V diagramu představují vodorovné čáry různé úrovně molekulární energie. Linka E0 je základní nebo nižší úroveň energie. Úrovně E1 a E2 jsou vzrušené úrovně vyšší energie. Hladiny E0, E1, E2 odpovídají elektronickým stavům molekuly.
Podúrovně 1, 2, 3, 4 v každé elektronické úrovni odpovídají různým vibračním stavům odpovídajícím každé elektronické úrovni. Každá z těchto úrovní má jemnější členění, u nichž není prokázáno, že odpovídají rotačním stavům spojeným s každou vibrační úrovní..
Diagram zobrazuje svislé šipky představující energii fotonů v infračerveném, viditelném a ultrafialovém rozsahu. Jak je vidět, infračervené fotony nemají dostatek energie na podporu elektronických přechodů, zatímco viditelné a ultrafialové záření ano..
Když se dopadající fotony monochromatického paprsku shodují v energii (nebo frekvenci) s energetickým rozdílem mezi stavy molekulární energie, dojde k absorpci fotonů..
Faktory, od kterých závisí propustnost
Podle toho, co bylo řečeno v předchozí části, bude propustnost potom záviset na několika faktorech, mezi nimiž můžeme jmenovat:
1- Frekvence, s níž je vzorek osvětlen.
2 - Typ molekul, které mají být analyzovány.
3 - Koncentrace roztoku.
4 - Délka dráhy, kterou prošel světelný paprsek.
Experimentální data ukazují, že propustnost T s koncentrací exponenciálně klesá C as délkou L optické dráhy:
T = 10-a⋅C⋅L
Ve výše uvedeném výrazu na je konstanta, která závisí na frekvenci a typu látky.
Cvičení vyřešeno
Cvičení 1
Standardní vzorek určité látky má koncentraci 150 mikromolů na litr (μM). Když je měřena jeho propustnost při světle 525 nm, je získána propustnost 0,4..
Další vzorek stejné látky, ale neznámé koncentrace, má propustnost 0,5, když se měří na stejné frekvenci a se stejnou optickou tloušťkou..
Vypočítejte koncentraci druhého vzorku.
Odpovědět
Propustnost T klesá exponenciálně s koncentrací C:
T = 10-b⋅L
Pokud se vezme logaritmus předchozí rovnosti, zůstane:
log T = -b⋅C
Rozdělení členu na člena předchozí rovnosti aplikované na každý vzorek a řešení pro neznámou koncentraci zůstává:
C2 = C1⋅ (log T2 / log T1)
C2 = 150 μM⋅ (log 0,5 / log 0,4) = 150 μM⋅ (-0,3010 / -0,3979) = 113,5 μM
Reference
- Atkins, P. 1999. Fyzikální chemie. Edice Omega. 460-462.
- Průvodce. Propustnost a absorbance. Obnoveno z: quimica.laguia2000.com
- Toxikologie prostředí. Propustnost, absorbance a Lambertův zákon. Obnoveno z: repositorio.innovacionumh.es
- Fyzické dobrodružství. Absorbance a propustnost. Obnoveno z: rpfisica.blogspot.com
- Spektrofotometrie. Obnoveno z: chem.libretexts.org
- Toxikologie prostředí. Propustnost, absorbance a Lambertův zákon. Obnoveno z: repositorio.innovacionumh.es
- Wikipedia. Přechod. Obnoveno z: wikipedia.com
- Wikipedia. Spektrofotometrie. Obnoveno z: wikipedia.com



Zatím žádné komentáře