
Historie wolframu, vlastnosti, struktura, použití
The wolfram, wolfram nebo wolfram je těžký přechodný kov, jehož chemickým symbolem je W. Nachází se v období 6 se skupinou 6 periodické tabulky a jeho atomové číslo je 74. Jeho název má dva etymologické významy: tvrdý kámen a vlčí pěna; druhé je proto, že tento kov je také známý jako wolfram.
Je to stříbřitě šedý kov, ai když je křehký, má velkou tvrdost, hustotu a vysoké teploty tání a varu. Proto se používá ve všech aplikacích, které zahrnují vysoké teploty, tlaky nebo mechanické síly, jako jsou vrtáky, projektily nebo vlákna emitující záření..

Nejznámější použití tohoto kovu na kulturní a populární úrovni je ve vláknech elektrických žárovek. Kdokoli s nimi manipuloval, uvědomí si, jak křehcí jsou; nejsou však vyrobeny z čistého wolframu, který je tvárný a tvárný. Kromě toho poskytuje v kovových matricích, jako jsou slitiny, vynikající odolnost a tvrdost.
Je charakterizován a vyznačuje se tím, že je to kov s nejvyšší teplotou tání, a také tím, že je hustší než samotné olovo, překonaný pouze jinými kovy, jako je osmium a iridium. Je to také nejtěžší kov, o kterém je známo, že hraje v těle biologickou roli..
Wolframanový anion, WO4dva-, které mohou polymerovat za vzniku shluků v kyselém prostředí. Na druhé straně, wolfram může tvořit intermetalické sloučeniny, nebo může být slinut s kovy nebo anorganickými solemi, takže jeho pevné látky získávají různé tvary nebo konzistence..
Není příliš hojný v zemské kůře, pouze 1,5 gramu tohoto kovu na tunu. Navíc, protože je to těžký prvek, jeho původ je intergalaktický; konkrétně z výbuchů supernov, které musely během formování vrhat „trysky“ atomů wolframu na naši planetu.
Rejstřík článků
- 1 Historie
- 1.1 Etymologie
- 1.2 Uznání a objev
- 1.3 Ocele a žárovky
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Atomové číslo
- 2.3 Molární hmotnost
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Hustota
- 2.7 Fúzní teplo
- 2.8 Odpařovací teplo
- 2.9 Molární tepelná kapacita
- 2.10 Mohova tvrdost
- 2.11 Elektronegativita
- 2.12 Atomový poloměr
- 2.13 Elektrický odpor
- 2.14 Izotopy
- 2.15 Chemie
- 2.16 Shlukování kyselin
- 3 Struktura a elektronická konfigurace
- 3.1 Krystalické fáze
- 3.2 Kovová vazba
- 3,3 oxidační stavy
- 4 Získání
- 5 použití
- 6 Rizika a bezpečnostní opatření
- 6.1 Biologické látky
- 6.2 Fyzické
- 7 Reference
Příběh
Etymologie
Historie wolframu nebo wolframu má dvě tváře, jako jsou jejich jména: jedna švýcarská a druhá německá. V 1600s, v regionech, které v současné době okupují Německo a Rakousko, horníci pracovali při těžbě mědi a cínu na výrobu bronzů.
Do té doby se horníci ocitli s trnem v procesu: byl extrémně obtížný minerál k roztavení; minerál sestávající z wolframitu (Fe, Mn, Mg) WO4, který zadržel nebo „pohltil“ plechovku, jako by to byl vlk.
Odtud pochází etymologie pro tento prvek, „vlk“ pro vlka ve španělštině, vlk, který jedl cín; a „beran“ z pěny nebo krému, jehož krystaly připomínaly dlouhou černou srst. Název „wolfram“ nebo „wolfram“ tedy vznikl na počest těchto prvních pozorování.
V roce 1758 byl na švýcarské straně podobný minerál, scheelit, CaWO4, byl pojmenován „tung sten“, což znamená „tvrdý kámen“.
Oba názvy, wolfram a wolfram, jsou široce používány zaměnitelně, záleží pouze na kultuře. Například ve Španělsku a v západní Evropě je tento kov nejlépe známý jako wolfram; zatímco na americkém kontinentu převládá název wolfram.
Uznání a objev
Tehdy se vědělo, že mezi sedmnáctým a osmnáctým stoletím existovaly dva minerály: wolframit a scheelit. Ale kdo viděl, že je v nich kov odlišný od ostatních? Mohly být charakterizovány pouze jako minerály a irský chemik Peter Woulfe v roce 1779 pečlivě analyzoval wolfram a odvodil existenci wolframu..
Na švýcarské straně byl Carl Wilhelm Scheele v roce 1781 schopen izolovat wolfram jako WO3; a ještě více získal kyselinu wolframovou (nebo wolframovou), HdvaWO4 a další sloučeniny.
To však nestačilo na to, abychom se dostali k čistému kovu, protože bylo nutné tuto kyselinu snížit; to znamená podrobit ho procesu tak, že se odpojil od kyslíku a krystalizoval jako kov. Carl Wilhelm Scheele neměl vhodné pece ani metodiku pro tuto chemickou redukční reakci.
Právě zde vstoupili do akce španělští bratři d'Elhuyar, Fausto a Juan José, kteří ve městě Bergara redukovali oba minerály (wolframit a scheelit) uhlím. Oběma byla udělena zásluha a čest být objevitelem kovového wolframu nebo wolframu (W).
Oceli a žárovky

Stejně jako jiné kovy, jeho použití definuje jeho historii. Mezi nejvýznamnější na konci 19. století patřily slitiny ocel-wolfram a wolframová vlákna, která nahradila uhlík v elektrických žárovkách. Dá se říci, že první žárovky, jak je známe, byly uvedeny na trh v letech 1903-1904.
Vlastnosti
Fyzický vzhled
Je to lesklý stříbrošedý kov. Křehký, ale velmi tvrdý (nezaměňovat s houževnatostí). Pokud je kus vysoké čistoty, stane se tvárný a tvrdý, stejně jako několik ocelí.
Protonové číslo
74.
Molární hmotnost
183,85 g / mol.
Bod tání
3422 ° C.
Bod varu
5930 ° C.
Hustota
19,3 g / ml.
Teplo fúze
52,31 kJ / mol.
Odpařovací teplo
774 kJ / mol.
Molární tepelná kapacita
24,27 kJ / mol.
Mohova tvrdost
7.5.
Elektronegativita
2,36 na Paulingově stupnici.
Atomové rádio
139 hodin
Elektrický odpor
52,8 nΩ · m při 20 ° C.
Izotopy
Vyskytuje se převážně v přírodě jako pět izotopů: 182Ž, 183Ž, 184Ž, 186W a 180W. Podle molární hmotnosti 183 g / mol, která zprůměruje atomové hmotnosti těchto izotopů (a dalších třicet radioizotopů), má každý wolfram nebo atom wolframu asi sto deset neutronů (74 + 110 = 184).
Chemie
Jedná se o kov vysoce odolný proti korozi, stejně jako jeho tenká vrstva WO3 Chrání jej před útokem kyslíku, kyselin a zásad. Po rozpuštění a vysrážení jinými činidly se získají jeho soli, které se nazývají wolframaty nebo wolframáty; v nich má wolfram obvykle oxidační stav +6 (za předpokladu, že jsou kationty W6+).
Shlukování kyselin
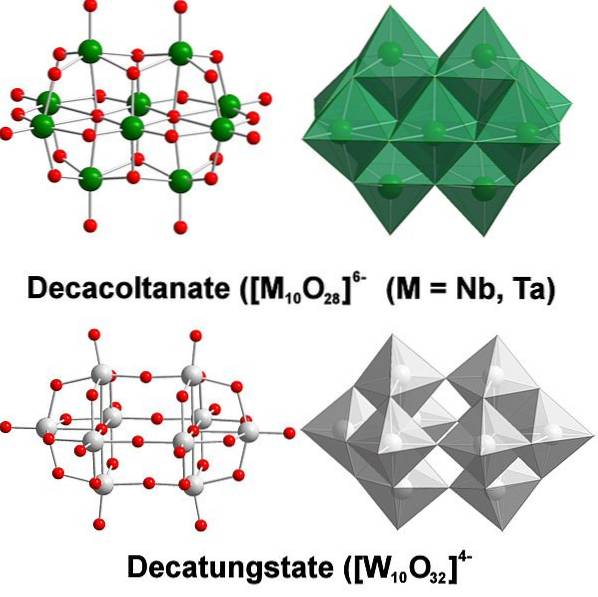
Chemicky je wolfram docela zvláštní, protože jeho ionty mají tendenci se shlukovat za vzniku heteropolykyselin nebo polyoxometalatů. Co jsou? Jsou to skupiny nebo shluky atomů, které se spojují, aby definovaly trojrozměrné tělo; Hlavně jeden se sférickou strukturou podobnou kleci, ve které „uzavírají“ další atom.
Všechno to začíná wolframovým aniontem, WO4dva-, který v kyselém prostředí rychle protonuje (HWO4-) a váže se sousedním aniontem za vzniku [WdvaNEBO7(ACH)dva]dva-; a to se zase spojí s dalším [ŽdvaNEBO7(ACH)dva]dva- vzniknout [W4NEBO12(ACH)4]4-. Takže dokud nebude v řešení několik politungstatů.
Paratungstates A a B, [W7NEBO24]6- a HdvaŽ12NEBO4210-, respektive jsou jedním z nejvýznamnějších z těchto polyaniontů.
Může být náročné přijít s tvým Lewisovým obrysem a strukturami; ale stačí je v zásadě představit jako množiny WO oktaedrů6 (horní obrázek).
Všimněte si, že tyto šedivé oktaedry nakonec definují dekatungstát, politungstat; pokud by uvnitř obsahoval heteroatom (například fosfor), pak by to byl polyoxometalát.
Struktura a elektronická konfigurace
Krystalické fáze
Atomy wolframu definují krystal s kubickou strukturou zaměřenou na tělo (bcc, pro centrovaný na tělo). Tato krystalická forma je známá jako fáze α; zatímco β fáze je také kubická, ale o něco hustší. Obě fáze nebo krystalické formy, α a β, mohou za normálních podmínek koexistovat v rovnováze.
Krystalická zrna fáze α jsou izometrická, zatímco zrna β fáze připomínají sloupce. Bez ohledu na to, jak je krystal, je řízen kovovými vazbami, které drží atomy W pevně pohromadě. Jinak nelze vysvětlit vysoké teploty tání a bodu varu nebo vysokou tvrdost a hustotu wolframu..
Kovová vazba
Atomy wolframu musí být nějak pevně vázány. Pro vytvoření domněnky je nejprve nutné dodržet elektronovou konfiguraci tohoto kovu:
[Xe] 4f145 d46 sdva
5d orbitaly jsou velmi velké a nejasné, což by znamenalo, že mezi dvěma blízkými atomy W existují účinná orbitální překrývání. Stejně tak orbitály 6s přispívají k výsledným pásmům, ale v menší míře. Zatímco orbitaly 4f jsou „hluboko v pozadí“, a proto je jejich příspěvek ke kovové vazbě menší.
Toto, velikost atomů a krystalická zrna, jsou proměnné, které určují tvrdost wolframu a jeho hustotu..
Oxidační stavy
Ve wolframu nebo kovovém wolframu mají atomy W nulový oxidační stav (W0). Vrátíme-li se k elektronické konfiguraci, mohou být orbitály 5d a 6s „vyprázdněny“ elektrony v závislosti na tom, zda je W ve společnosti vysoce elektronegativních atomů, jako je kyslík nebo fluor..
Když jsou ztraceny dva elektrony 6s, wolfram má oxidační stav +2 (W.dva+), což způsobí smrštění jeho atomu.
Pokud také ztratí všechny elektrony na svých 5d orbitalech, stane se jeho oxidační stav +6 (W.6+); Odtud se to teoreticky nemůže stát pozitivnějším, protože orbitaly 4f, protože jsou vnitřní, by k odstranění svých elektronů vyžadovaly velké energie. To znamená, že nejpozitivnější oxidační stav je +6, kde je wolfram ještě menší.
Tento wolfram (VI) je velmi stabilní v kyselých podmínkách nebo v mnoha okysličených nebo halogenovaných sloučeninách. Další možné a pozitivní oxidační stavy jsou: +1, +2, +3, +4, +5 a +6.
Wolfram může také získat elektrony, pokud se spojí s atomy, které jsou méně elektronegativní než on. V tomto případě se jeho atomy zvětší. Může získat maximálně čtyři elektrony; to znamená, že mají oxidační stav -4 (W.4-).
Získávání
Již bylo zmíněno, že wolfram se nachází v minerálech wolframit a scheelit. V závislosti na procesu se z nich získávají dvě sloučeniny: oxid wolframu, WO3, nebo paratungstát amonný (NH4)10(HdvaŽ12NEBO42) · 4HdvaO (nebo ATP). Kterýkoli z nich lze snížit na kovový W s uhlíkem nad 1050 ° C.
Není ekonomicky výhodné vyrábět wolframové ingoty, protože k jejich roztavení by potřebovali hodně tepla (a peněz). Proto je výhodné vyrábět jej v práškové formě a současně ho ošetřit jinými kovy, aby se získaly slitiny..
Za zmínku stojí, že Čína je zemí s největší produkcí wolframu na světě. A na americkém kontinentu, v Kanadě, Bolívii a Brazílii, také zaujímají seznam největších výrobců tohoto kovu.
Aplikace

Zde jsou některá ze známých použití tohoto kovu:
-Jeho soli se používaly k barvení bavlny starého divadelního oblečení.
-V kombinaci s ocelí to ještě více zpevňuje a je dokonce schopné odolat mechanickým řezům při vysokých rychlostech.
-Slinutá wolframová vlákna se používají již více než sto let v elektrických žárovkách a halogenových žárovkách. Díky své vysoké teplotě tání také sloužil jako materiál pro katodové trubice a pro trysky raketových motorů..
-Nahrazuje olovo při výrobě projektilů a radioaktivních štítů.
-Wolframové nanodráty lze použít v nanočásticích citlivých na pH a plyn.
-Wolframové katalyzátory byly použity k řešení produkce síry v ropném průmyslu.
-Karbid wolframu je nejpoužívanější ze všech jeho sloučenin. Od posilování řezných a vrtacích nástrojů nebo výroby kusů vojenské výzbroje až po obrábění dřeva, plastů a keramiky.
Rizika a opatření
Biologický
Jelikož se jedná o relativně vzácný kov v zemské kůře, jeho negativní účinky jsou vzácné. V kyselých půdách nemusí polyungstáty ovlivňovat enzymy, které používají molybdenanové anionty; ale v základních půdách je to WO4dva- zasahuje (pozitivně nebo negativně) do metabolických procesů MoO4dva- a měď.
Rostliny například mohou absorbovat rozpustné sloučeniny wolframu, a když je zvíře zožere a poté po konzumaci masa vstoupí do našich těl atomy W. Většina je vylučována močí a výkaly a málo se ví, co se stane s ostatními..
Studie na zvířatech ukázaly, že při vdechování vysokých koncentrací práškového wolframu se u nich rozvinou podobné příznaky jako u rakoviny plic.
Při požití by dospělý člověk musel vypít tisíce galonů vody obohacené wolframovými solemi, aby prokázal znatelnou inhibici enzymů cholinesterázy a fosfatázy..
Fyzický
Obecně je wolfram nízko toxický prvek, a proto existuje jen málo environmentálních rizik pro poškození zdraví..
Pokud jde o kovový wolfram, vyvarujte se vdechování jeho prachu; a pokud je vzorek pevný, je třeba mít na paměti, že je velmi hustý a že může způsobit fyzické poškození, pokud spadne nebo zasáhne jiný povrch.
Reference
- Bell Terence. (s.f.). Tungsten (Wolfram): Vlastnosti, výroba, aplikace a slitiny. Rovnováha. Obnoveno z: thebalance.com
- Wikipedia. (2019). Wolfram. Obnoveno z: en.wikipedia.org
- Lenntech B.V. (2019). Wolfram. Obnoveno z: lenntech.com
- Jeff Desjardins. (1. května 2017). Historie wolframu, nejsilnějšího přírodního kovu na Zemi. Obnoveno z: visualcapitalist.com
- Doug Stewart. (2019). Fakta o prvku wolframu. Obnoveno z: chemicool.com
- Art Fisher a Pam Powell. (s.f.). Wolfram. University of Nevada. Obnoveno z: unce.unr.edu
- Helmenstine, Anne Marie, Ph.D. (2. března 2019). Fakta o wolframu nebo wolframu. Obnoveno z: thoughtco.com



Zatím žádné komentáře