
Konfigurace a sloučeniny dusíkatých valencí

The valence dusíku Pohybují se od -3, jako u amoniaku a aminů, do +5 jako u kyseliny dusičné (Tyagi, 2009). Tento prvek nerozšiřuje valence jako ostatní.
Atom dusíku je chemický prvek s atomovým číslem 7 a první prvek skupiny 15 (dříve VA) periodické tabulky. Skupinu tvoří dusík (N), fosfor (P), arsen (As), antimon (Sb), vizmut (Bi) a moscovium (Mc).

Prvky sdílejí určité obecné podobnosti v chemickém chování, i když se od sebe chemicky jasně liší. Tyto podobnosti odrážejí společné charakteristiky elektronických struktur jejich atomů (Sanderson, 2016).
Dusík je přítomen téměř ve všech bílkovinách a hraje důležitou roli v biochemických i průmyslových aplikacích. Dusík vytváří silné vazby díky své schopnosti tvořit trojnou vazbu s dalším atomem dusíku a dalšími prvky..
Proto je ve sloučeninách dusíku velké množství energie. Před 100 lety se o dusíku vědělo jen málo. Nyní se dusík běžně používá k konzervování potravin a jako hnojivo (Wandell, 2016).
Elektronická konfigurace a valence
V atomu elektrony plní různé úrovně podle svých energií. První elektrony naplní nižší energetické úrovně a poté se přesunou na vyšší energetickou hladinu.
Nejvzdálenější energetická hladina v atomu je známá jako valenční skořápka a elektrony umístěné v této skořápce jsou známé jako valenční elektrony..
Tyto elektrony se vyskytují hlavně při tvorbě vazeb a chemické reakci s jinými atomy. Valenční elektrony jsou proto odpovědné za různé chemické a fyzikální vlastnosti prvku (Valence Electrons, S.F.).
Dusík, jak již bylo zmíněno, má atomové číslo Z = 7. To znamená, že jeho plnění elektronů v jejich energetických úrovních nebo elektronové konfiguraci je 1Sdva 2Sdva 2 str3.
Je třeba si uvědomit, že v přírodě se atomy vždy snaží mít elektronickou konfiguraci vzácných plynů, a to buď získáváním, ztrátou nebo sdílením elektronů..
V případě dusíku je ušlechtilý plyn, který usiluje o elektronickou konfiguraci, neonový, jehož atomové číslo je Z = 10 (1Sdva 2Sdva 2 str6) a helium, jehož atomové číslo je Z = 2 (1Sdva) (Reusch, 2013).
Různé způsoby, jak se musí dusík kombinovat, mu dají valenci (nebo oxidační stav). Ve specifickém případě dusíku, protože je ve druhé periodě periodické tabulky, není schopen rozšířit svou valenční skořápku tak, jak to dělají ostatní prvky její skupiny..
Očekává se, že bude mít valence -3, +3 a +5. Dusík má však valenční stavy v rozmezí od -3 jako v amoniaku a aminech do +5 jako v kyselině dusičné. (Tyagi, 2009).
Teorie valenčních vazeb pomáhá vysvětlit vznik sloučenin podle elektronové konfigurace dusíku pro daný oxidační stav. K tomu je třeba vzít v úvahu počet elektronů ve valenčním plášti a kolik zbývá k získání konfigurace vzácného plynu..
Sloučeniny dusíku
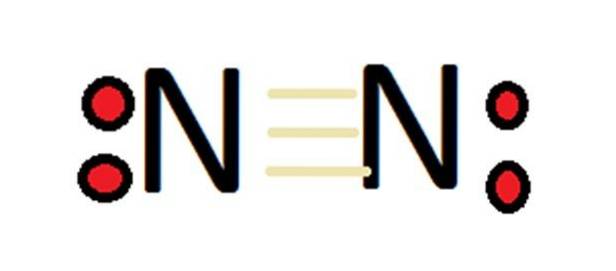
Vzhledem k vysokému počtu oxidačních stavů může dusík tvořit velké množství sloučenin. V první řadě je třeba si uvědomit, že v případě molekulárního dusíku je podle definice jeho valence 0.
Oxidační stav -3 je pro prvek jeden z nejběžnějších. Příklady sloučenin s tímto oxidačním stavem jsou amoniak (NH3), aminy (R3N), amonný iont (NH4+), iminy (C = N-R) a nitrily (C≡N).
V oxidačním stavu -2 je dusíku ponecháno 7 elektronů ve valenčním obalu. Tento lichý počet elektronů ve valenčním plášti vysvětluje, proč mají sloučeniny s tímto oxidačním stavem můstkovou vazbu mezi dvěma dusíky. Příklady sloučenin s tímto oxidačním stavem jsou hydraziny (R.dva-N-N-Rdva) a hydrazony (C = N-N-Rdva).
V -1 oxidačním stavu je dusíku ponecháno 6 elektronů ve valenčním plášti. Příkladem sloučenin dusíku s touto valencí jsou hydroxylamin (R.dvaNOH) a azosloučeniny (RN = NR).
V pozitivních oxidačních stavech je dusík obecně vázán na atomy kyslíku za vzniku oxidů, oxysolů nebo oxokyselin. V případě oxidačního stavu +1 má dusík ve své valenční skořápce 4 elektrony.
Příklady sloučenin s touto valencí jsou oxid dusný nebo smějící se plyn (NdvaO) a nitrososloučeniny (R = NO) (Reusch, Oxidation States of Nitrogen, 2015).
V případě oxidačního stavu +2 je příkladem oxid dusnatý nebo oxid dusnatý (NO), bezbarvý plyn vznikající reakcí kovů se zředěnou kyselinou dusičnou. Tato sloučenina je extrémně nestabilní volný radikál, protože reaguje s Odva ve vzduchu za vzniku NO plynudva.
Dusitany (čdva-) v zásaditém roztoku a kyselině dusité (HNOdva) v kyselém roztoku jsou příklady sloučenin s oxidačním stavem +3. Může se jednat o oxidační činidla, která normálně produkují NO (g), nebo redukční činidla za vzniku dusičnanového iontu..
Oxid dusný (NdvaNEBO3) a nitroskupina (R-NOdva) jsou další příklady sloučenin dusíku s valencí +3.
Oxid dusičitý (NOdva) nebo oxid dusičitý je sloučenina dusíku s valencí +4. Je to hnědý plyn, který se obvykle vyrábí reakcí koncentrované kyseliny dusičné s mnoha kovy. Dimerizuje za vzniku NdvaNEBO4.
Ve stavu +5 najdeme dusičnany a kyselinu dusičnou, což jsou oxidační činidla v kyselých roztocích. V tomto případě má dusík ve valenčním plášti 2 elektrony, které jsou v orbitálu 2S. (Oxidační stavy dusíku, S.F.).
Existují také sloučeniny, jako je nitrosilazid a oxid dusný, kde má dusík v molekule různé oxidační stavy. V případě nitrosilazidu (N4O) dusík má valenci -1, 0, +1 a +2; a v případě oxidu dusného má valenci +2 a +4.
Názvosloví sloučenin dusíku
Vzhledem ke složitosti chemie sloučenin dusíku nestačila tradiční nomenklatura k jejich pojmenování, natož k jejich správné identifikaci. Proto mimo jiné vytvořila Mezinárodní unie pro čistou a aplikovanou chemii (IUPAC) systematickou nomenklaturu, kde jsou sloučeniny pojmenovány podle počtu atomů, které obsahují..
To je výhodné, pokud jde o pojmenování oxidů dusíku. Například oxid dusnatý by byl pojmenován oxid dusnatý a oxid dusný (NO) oxid dusný (NdvaNEBO).
V roce 1919 navíc německý chemik Alfred Stock vyvinul metodu pro pojmenování chemických sloučenin na základě oxidačního stavu, která je napsána římskými číslicemi v závorkách. Například oxid dusnatý a oxid dusný by se nazývaly oxid dusnatý (II) a oxid dusnatý (I) (IUPAC, 2005).
Reference
- (2005). NOMENKLATURA ANORGANICKÉ CHEMIE Doporučení IUPAC 2005. Obnoveno z iupac.org.
- Oxidační stavy dusíku. (S.F.). Obnoveno z kpu.ca.
- Reusch, W. (2013, 5. května). Konfigurace elektronů v periodické tabulce. Obnoveno z chemistry.msu.edu.
- Reusch, W. (2015, 8. srpna). Oxidační stavy dusíku. Obnoveno z chem.libretexts.org.
- Sanderson, R. T. (2016, 12. prosince). Prvek skupiny dusíku. Obnoveno z britannica.com.
- Tyagi, V. P. (2009). Základní chemie XII. New Deli: Ratna Sagar.
- Valenční elektrony. (S.F.). Obnoveno z chemistry.tutorvista.com.
- Wandell, A. (2016, 13. prosince). Chemie dusíku. Obnoveno z chem.libretexts.org.


Zatím žádné komentáře