
Vlastnosti, struktura, použití oxidu chloričitého (V)
The oxid chloričitý (V) je vysoce nestabilní anorganická sloučenina, jejíž chemický vzorec je CldvaNEBO5. Je to jeden z mnoha oxidů chloru, které se vyznačují tím, že jsou molekulárními nebo dokonce radikálovými druhy.
CldvaNEBO5 Život našel pouze v papírových a teoretických výpočtech; jeho existence však nebyla vyloučena a je pravděpodobné, že některé lze charakterizovat (pomocí pokročilých spektroskopických technik). Z obecných chemických konceptů tohoto oxidu lze předvídat, že jde o anhydrid kyseliny chlorovodíkové, HClO3.
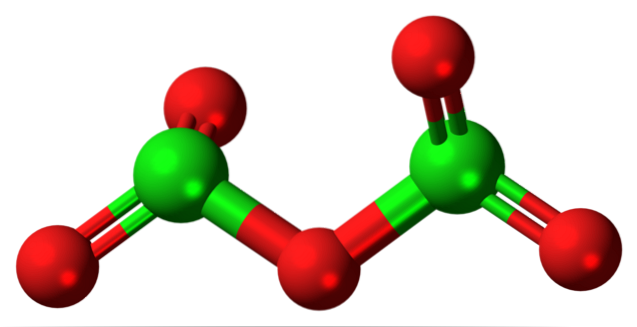
Hypotetická molekula oxidu chloru (V) je uvedena výše. Všimněte si, že protože se jedná o molekulu, přítomnost Cl iontu se vůbec neuvažuje+5; ještě méně, když musí mít takovou polarizační sílu, aby donutila kyslík kovalentně se vázat.
Jako všechny nestabilní sloučeniny uvolňuje energii k rozpadu na stabilnější produkty; proces, který je v mnoha případech výbušný. Když CldvaNEBO5 rozkládá uvolňuje ClOdva mědva. Předpokládá se, že ve vodě, v závislosti na izomeru CldvaNEBO5, mohou tvořit různé kysličníky chloru.
Rejstřík článků
- 1 Vlastnosti
- 2 Struktura oxidu chloričitého (V)
- 2.1 Molekula
- 2.2 Lewisova struktura
- 2.3 Izomery a jejich příslušná hydrolýza
- 3 Názvosloví
- 4 použití
- 5 Reference
Vlastnosti
Molární hmotnost CldvaNEBO5 je to 150,9030 g / mol. Z této hmoty a její hypotetické molekuly lze usoudit, že pokud by ji bylo možné izolovat, pravděpodobně by to byla olejovitá kapalina; samozřejmě při srovnání s fyzickým vzhledem CldvaNEBO7.
I když jej nelze izolovat ani charakterizovat, je tento oxid chloričitý, kovalentní a musí mít také malý dipólový moment. Jeho kyselost je pochopitelná, pokud se analyzuje chemická rovnice jeho hydrolýzy:
CldvaNEBO5 + HdvaO 2HClO3
Být HClO3 kyselina chlorovodíková. Reverzní reakce by vedla v případě, že by kyselina mohla být dehydratována:
2HClO3 => CldvaNEBO5 + HdvaNEBO
Na druhou stranu, když CldvaNEBO5 těžko produkovaný, rozkládá se:
2CldvaNEBO5 => 4ClOdva + NEBOdva
Jedná se tedy spíše o zprostředkující druh než o oxid. Jeho rozklad musí být tak rychlý (vzhledem k tomu, že i CldvaNEBO5), který nebyl detekován současnými technikami instrumentální analýzy.
Struktura oxidu chloričitého (V)
Molekula
Na horním obrázku byla ukázána struktura hypotetické molekuly Cl.dvaNEBO5 s modelem koulí a tyčí. Červené koule představují atomy kyslíku a zelené koule představují atomy chloru. Každý chlor má prostředí trigonální pyramidy, takže jeho hybridizace musí být sp3.
Molekula CldvaNEBO5 lze to vidět jako dvě trigonální pyramidy spojené kyslíkem. Pokud se ale podíváte pozorně, jedna pyramida orientuje své atomy kyslíku dolů, druhá mimo rovinu (směrem k čtenáři)..
Proto se předpokládá, že v O spojení existují rotacedvaCl-O-ClOdva, což dělá molekulu relativně dynamickou. Všimněte si, že vzorec OdvaCHLOClOdva je způsob reprezentace struktury CldvaNEBO5.
Lewisova struktura
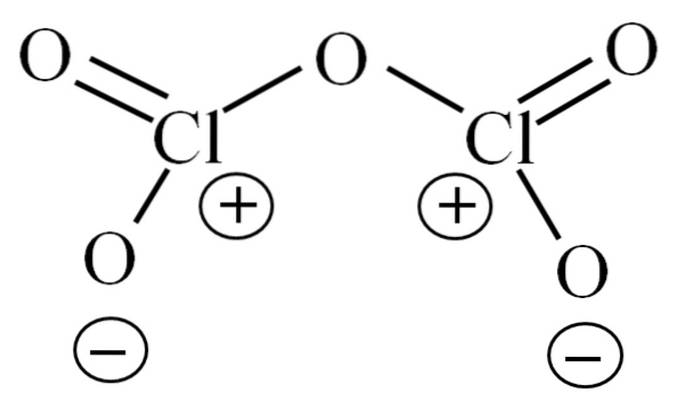
Až dosud molekula sama o sobě neumožňovala dešifrovat, co je způsobeno její nestabilitou. Abychom tuto otázku osvětlili, obrátíme se na její Lewisovu strukturu, která je znázorněna výše. Upozorňujeme, že struktura může být mylně považována za plochou, ale v předchozí podsekci bylo objasněno, že tomu tak není..
Proč mají oba atomy chloru kladné formální náboje? Vzhledem k tomu, že v chloru zbývá volný pár elektronů, což lze ověřit použitím Valencia Bond Theory (což zde pro zjednodušení nebude provedeno). Jeho formální zatížení je tedy:
CF = 7 - (4 + 2) = 1
A co to má společného s jejich nestabilitou? Chlór je značně elektronegativní, a proto je špatným nosičem pozitivních formálních nábojů. Tím se vrací do CldvaNEBO5 vysoce kyselý druh, protože potřebuje získat elektrony, aby uspokojil elektronickou poptávku po těchto dvou chlórech.
U BrdvaNEBO5 a jádvaNEBO5, oxidy, které existují za normálních podmínek. Je to proto, že jak brom, tak jod jsou méně elektronegativní než chlor; a proto lépe podporují pozitivní formální poplatek.
Izomery a jejich příslušná hydrolýza
Celé vysvětlení zatím padlo na jeden ze dvou izomerů CldvaNEBO5: O.dvaCHLOClOdva. Který je ten druhý? O3CHLOClO. V tomto izomeru chybí chlorům formální kladné náboje, a měl by proto být stabilnější molekulou. Nicméně oba OdvaCHLOClOdva jako O.3ClOClO by měl podstoupit hydrolýzní reakce:
NEBOdvaCl-O-ClOdva + HdvaO => 2OdvaCl-OH (které nejsou ničím jiným než HClO3)
NEBO3Cl-O-ClO + HdvaO => O3Cl-OH (HClO4) + HO-ClO (HClOdva)
Pamatujte, že mohou vznikat až tři chlorooxokyseliny: HClO3, HClO4 a HClOdva
Nomenklatura
Jeho název „oxid chloričitý (V)“ odpovídá názvu přiřazenému podle nomenklatury zásob. CldvaNEBO5 Může mít také dva další názvy: dichlorpentaoxid a chloridový anhydrid, přiřazené systematickou a tradiční nomenklaturou..
Aplikace
Více než motivující výpočetní studie, CldvaNEBO5 Nebude použit, dokud nebude objeven, izolován, charakterizován, uložen a nebude prokázáno, že exploduje při sebemenším kontaktu..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Sandra Luján Quiroga a Luis José Perissinotti. (2011). Oxidy chloru a struktura dichloroxidů. Chem. Educator, sv. 16.
- Chemická formulace. (2019). Chlordioxid (V). Obnoveno z: formulacionquimica.com
- Linus Pauling. (1988). Obecná chemie. Dover Publications, INC., New York.
- Richard C. Ropp. (2013). Encyklopedie sloučenin alkalické Země. Elsevier.



Zatím žádné komentáře