
Vzorec oxidu lithného, vlastnosti, rizika a použití

The oxid lithný Je to anorganická chemická sloučenina vzorce LidvaNebo se tvoří spolu s malým množstvím peroxidu lithného, když kov lithia hoří na vzduchu a kombinuje se s kyslíkem..
Do 90. let na trhu s kovem a lithiem dominovala produkce USA z ložisek nerostných surovin, ale na počátku 21. století byla většina produkce odvozena z jiných zdrojů než USA; Austrálie, Chile a Portugalsko byly nejdůležitějšími dodavateli na světě. Bolívie má polovinu ložisek lithia na světě, ale není velkým producentem.
Nejdůležitější obchodní formou je uhličitan lithný, LidvaCO3, vyráběné z minerálů nebo solných roztoků několika různými procesy.
Při spalování lithia na vzduchu je hlavním produktem bílý oxid oxidu lithného, LidvaO. Kromě toho se vyrábí určité množství peroxidu lithného, LidvaNEBOdva, také bílá.
Toho lze dosáhnout také tepelným rozkladem hydroxidu lithného, LiOH nebo peroxidu lithného, Li2O2.
4Li (s) + O.dva(g) → 2LidvaVy)
2 LiOH (y) + teplo → LidvaO (s) + HdvaO (g)
2LidvaNEBOdva(s) + teplo → 2LidvaO (s) + Odva(G)
Fyzikální a chemické vlastnosti
Oxid lithný je bílá pevná látka známá jako lithia, která postrádá aroma a má slanou chuť. Jeho vzhled je znázorněn na obrázku 2 (National Center for Biotechnology Information, 2017).

Obrázek 2: Vzhled oxidu lithného
Oxid lithný jsou krystaly s antifloritovou geometrií podobné chloridu sodnému (krychlový na střed). Jeho krystalická struktura je uvedena na obrázku 3 (Mark Winter [The University of Sheffield and WebElements Ltd, 2016).
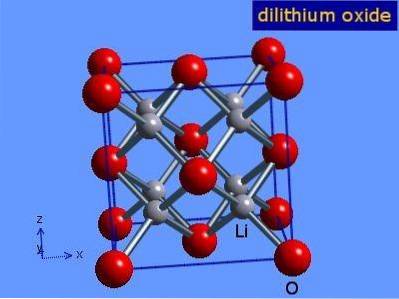
Obrázek 3: Krystalická struktura oxidu lithného.
Jeho molekulová hmotnost je 29,88 g / mol, jeho hustota je 2,013 g / ml a jeho teploty tání a varu jsou 1438 ° C, respektive 2066 ° C. Sloučenina je velmi rozpustná ve vodě, alkoholu, etheru, pyridinu a nitrobenzenu (Royal Society of Chemistry, 2015).
Oxid lithný snadno reaguje s vodní párou za vzniku hydroxidu a s oxidem uhličitým za vzniku uhličitanu; proto musí být skladovány a manipulováno v čisté a suché atmosféře..
Oxidové sloučeniny nevodí elektřinu. Určité strukturované oxidy perovskitu jsou však elektronické vodiče, které nacházejí uplatnění v katodě palivových článků na tuhý oxid a v systémech generování kyslíku..
Jsou to sloučeniny, které obsahují alespoň jeden kyslíkový anion a jeden kovový kation (American Elements, S.F.).
Reaktivita a nebezpečí
Oxid lithný je stabilní sloučenina nekompatibilní se silnými kyselinami, vodou a oxidem uhličitým. Pokud je nám známo, chemické, fyzikální a toxikologické vlastnosti oxidu lithného nebyly důkladně prozkoumány a popsány..
Toxicita sloučenin lithia je funkcí jejich rozpustnosti ve vodě. Lithiový iont má toxicitu pro centrální nervový systém. Sloučenina je vysoce žíravá a dráždivá při styku s očima, pokožkou při vdechování nebo požití (ESPI METALS, 1993).
V případě kontaktu s očima zkontrolujte, zda nosíte kontaktní čočky, a ihned je vyjměte. Oči by měly být proplachovány tekoucí vodou po dobu nejméně 15 minut, přičemž víčka udržujte otevřená. Lze použít studenou vodu. Oční mast by se neměla používat.
Pokud chemikálie přijde do styku s oděvem, co nejdříve ji odstraňte, abyste si chránili ruce a tělo. Umístěte postiženého pod bezpečnostní sprchu.
Pokud se chemikálie hromadí na exponované pokožce oběti, například na rukou, kontaminovaná kůže se jemně a opatrně omyje tekoucí vodou a neabrazivním mýdlem. Lze použít studenou vodu. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc. Kontaminovaný oděv před dalším použitím vyperte.
V případě vdechnutí by měl být postižený ponechán v klidu na dobře větraném místě. Pokud je vdechnutí těžké, měla by být oběť co nejdříve evakuována do bezpečného prostoru..
Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata. Pokud postižený dýchá obtížně, měl by být podán kyslík. Pokud postižený nedýchá, provede se resuscitace z úst do úst.
Vždy mějte na paměti, že pro osobu poskytující pomoc může být resuscitace z úst do úst nebezpečná, pokud je vdechovaný materiál toxický, infekční nebo žíravý..
Ve všech případech je třeba vyhledat okamžitou lékařskou pomoc (SIGMA-ALDRICH, 2010).
Aplikace
Oxid lithný se používá jako tavidlo v keramických glazurách a vytváří blues s mědí a růžové s kobaltem. Oxid lithný reaguje s vodou a parami za vzniku hydroxidu lithného a musí být z nich izolován.
Oxid lithný (LidvaO) se svým vysokým tritiovým potenciálem je atraktivním kandidátem na pevný kultivační materiál fúzní elektrárny DT díky své vysoké hustotě atomů lithia (ve srovnání s jinou lithiovou nebo lithiovou kovovou keramikou) a své vodivosti relativně vysoké tepelné (OXID LITHIUM (Li2O), SF).
LidvaNebo bude vystaven vysokým teplotám při ozařování neutrony během provozu tavicí pokrývky. Za těchto okolností se v Li vyskytne velké množství vad ozářenídvaNebo jako je bobtnání vyvolané heliem, relativně vysoká tepelná roztažnost, růst zrn, tvorba LiOH (T) a srážení při nízkých teplotách a transport hmoty LiOH (T) při vysokých teplotách.
Dále LidvaNebo bude vystaven napětím vyplývajícím z rozdílů v tepelné roztažnosti mezi LidvaNebo a konstrukční materiály. Tyto vlastnosti LidvaNebo vést k náročným technickým problémům jak v plošné výrobě, tak v designu.
Jedno možné nové použití je jako náhrada za lithium-kobaltový oxid, jako je katoda v lithium-iontových bateriích používaných k napájení elektronických zařízení z mobilních telefonů do notebooků i aut s bateriemi (Reade International Corp, 2016)..
Reference
- Mark Winter [The University of Sheffield and WebElements Ltd. (2016). webové prvky. Převzato z lithia: dilithium oxid webelements.com.
- Americké prvky. (S.F.). Oxid lithný. Převzato z americanelements americanelements.com.
- ESPI METALS. (1993, červen). Oxid lithný. Převzato z espimetals espimetals.com.
- OXID LITHIUM (Li2O). (S.F.). Převzato z ferp.ucsd.edu ferp.ucsd.edu.
- Národní centrum pro biotechnologické informace. (2017, 24. června). Složená databáze PubChem; CID = 166630. Převzato z PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Prášek oxidu lithného (Li2O). Převzato z reade reade.com
- Royal Society of Chemistry. (2015). Oxid lithný.Převzato z chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Bezpečnostní list materiálu Oxid lithný. Převzato z chemblink chemblink.com.


Zatím žádné komentáře