
Jak vypočítat molární nasákavost a vyřešená cvičení
The molární nasákavost je to chemická vlastnost, která udává, kolik světla může druh absorbovat v roztoku. Tento koncept je velmi důležitý ve spektroskopické analýze absorpce fotonového záření s energiemi v ultrafialovém a viditelném rozsahu (UV-vis)..
Protože světlo se skládá z fotonů s vlastní energií (nebo vlnovými délkami), v závislosti na analyzovaném druhu nebo směsi může být jeden foton absorbován ve větší míře než jiný; to znamená, že světlo je absorbováno při určitých vlnových délkách charakteristických pro látku.

Hodnota molární absorpce je tedy přímo úměrná stupni absorpce světla při dané vlnové délce. Pokud druh absorbuje malé červené světlo, bude jeho hodnota absorpce nízká; zatímco při výrazné absorpci červeného světla bude mít absorpční schopnost vysokou hodnotu.
Druh absorbující červené světlo bude odrážet zelenou barvu. Pokud je zelená barva velmi intenzivní a tmavá, znamená to, že dochází k silné absorpci červeného světla.
Některé odstíny zelené však mohou být způsobeny odrazy různých rozsahů žluté a modré barvy, které jsou smíšené a vnímané jako tyrkysová, smaragdová, skleněná atd..
Rejstřík článků
- 1 Co je molární nasákavost?
- 1.1 Jednotky
- 2 Jak to vypočítat?
- 2.1 Přímé odbavení
- 2.2 Metoda vytváření grafů
- 3 Vyřešená cvičení
- 3.1 Cvičení 1
- 3.2 Cvičení 2
- 4 Odkazy
Co je molární nasákavost?
Molární nasákavost je známa také pod následujícími označeními: specifický zánik, koeficient molárního útlumu, specifická absorpce nebo Bunsenův koeficient; Dokonce se začalo jmenovat jinými způsoby, takže to bylo zdrojem zmatku.
Ale co přesně je molární nasákavost? Je to konstanta, která je definována v matematickém vyjádření Lamber-Beerova zákona a jednoduše udává, kolik chemické látky nebo směsi absorbují světlo. Taková rovnice je:
A = εbc
Kde A je absorbance roztoku při vybrané vlnové délce λ; b je délka buňky, kde je obsažen vzorek, který má být analyzován, a proto je vzdálenost, kterou světlo prochází v roztoku; c je koncentrace absorbujících druhů; a ε, molární nasákavost.
Vzhledem k λ, vyjádřenému v nanometrech, zůstává hodnota ε konstantní; ale při změně hodnot λ, tj. při měření absorbance se světly jiných energií, ε se mění a dosahuje buď minimální, nebo maximální hodnoty.
Pokud je známa jeho maximální hodnota, εmax, se stanoví současně λmax; tj. světlo, které druh absorbuje nejvíce:
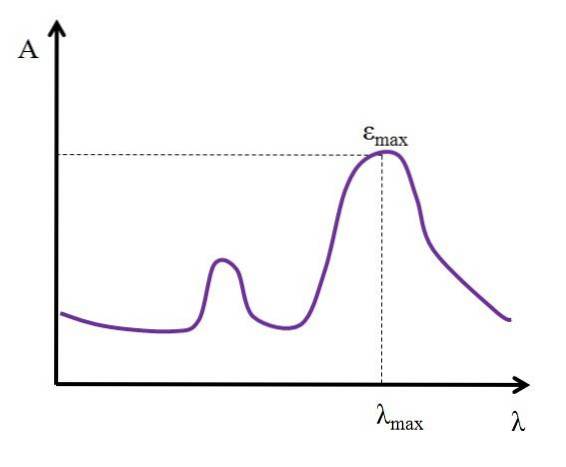
Jednotky
Jaké jsou jednotky ε? Abychom je našli, je třeba vědět, že absorbance jsou bezrozměrné hodnoty; a proto násobení jednotek bac musí zrušit.
Koncentrace absorbujících druhů může být vyjádřena buď v g / L nebo mol / L, a b je obvykle vyjádřeno v cm nebo m (protože to je délka buňky, kterou světelný paprsek prochází). Molarita se rovná mol / L, takže c je také vyjádřeno jako M..
Když tedy vynásobíme jednotky b a c, získáme: M ∙ cm. Jaké jednotky pak musí mít ε, aby hodnota A byla bezrozměrná? Ty, které vynásobí M ∙ cm, dávají hodnotu 1 (M ∙ cm x U = 1). Při řešení pro U jednoduše získáme M-1∙ cm-1, kterou lze také napsat jako: L ∙ mol-1∙ cm-1.
Ve skutečnosti použijte jednotky M.-1∙ cm-1 nebo L ∙ mol-1∙ cm-1 urychlit výpočty k určení molární absorpce. Často se však také vyjadřuje v jednotkách mdva/ mol nebo cmdva/ mol.
Když jsou vyjádřeny těmito jednotkami, je třeba použít některé převodní faktory k úpravě jednotek b a c.
Jak to vypočítat?
Přímé odbavení
Molární nasákavost lze vypočítat přímo jejím řešením ve výše uvedené rovnici:
ε = A / bc
Jsou-li známy koncentrace absorbujících druhů, délka buněk a absorbance získané při vlnové délce, lze vypočítat ε. Tento způsob výpočtu však vrací nepřesnou a nespolehlivou hodnotu.
Grafická metoda
Pokud se podíváte pozorně na Lambert-Beerovu rovnici, všimnete si, že vypadá jako rovnice přímky (Y = aX + b). To znamená, že pokud jsou hodnoty A vykresleny na ose Y a hodnoty c na ose X, musí být získána přímka, která prochází počátkem (0,0). Tak by se A stalo Y, X by bylo c a a by se rovna εb.
Jakmile je tedy čára v grafu, k určení sklonu stačí vzít libovolné dva body, tj. A. Jakmile je toto provedeno a je známa délka buňky b, je snadné ji vyřešit pro hodnotu ε.
Na rozdíl od přímé vůle grafy A vs c umožňují zprůměrování měření absorbance a snižují experimentální chybu; a navíc nekonečné čáry mohou projít jediným bodem, takže přímá vůle není praktická.
Podobně mohou experimentální chyby způsobit, že čára neprojde dvěma, třemi nebo více body, takže se ve skutečnosti použije čára získaná po použití metody nejmenších čtverců (funkce, která je již součástí kalkulaček). To vše za předpokladu vysoké linearity, a tedy souladu s Lamber-Beerovým zákonem..
Vyřešená cvičení
Cvičení 1
Je známo, že roztok organické sloučeniny s koncentrací 0,008739 M vykazoval absorbanci 0,6346, měřenou při X = 500 nm a s délkou buňky 0,5 cm. Vypočítejte molární nasákavost komplexu při této vlnové délce.
Z těchto údajů lze ε vyřešit přímo:
ε = 0,6346 / (0,5 cm) (0,008739 M)
145,23 mil-1∙ cm-1
Cvičení 2
Následující absorbance se měří při různých koncentracích kovového komplexu při vlnové délce 460 nm as buňkou o délce 1 cm:
A: 0,03010 0,1033 0,1584 0,3961 0,8093
c: 1,8 ∙ 10-5 6 ∙ 10-5 9,2 ∙ 10-5 2,3 ∙ 10-4 5,6 ∙ 10-4
Vypočítejte molární nasákavost komplexu.
Existuje celkem pět bodů. Pro výpočet ε je nutné je zobrazit v grafu umístěním hodnot A na osu Y a koncentrací c na osu X. Jakmile je to provedeno, určí se čára nejmenších čtverců a pomocí její rovnice můžeme určit ε.
V tomto případě vykreslení bodů a nakreslení čáry s koeficientem stanovení Rdva 0,9905, sklon se rovná 7 ∙ 10-4; tj. εb = 7 ∙ 10-4. Proto s b = 1 cm bude ε 1428,57 M-1.cm-1 (1/7 ∙ 10-4).
Reference
- Wikipedia. (2018). Součinitel molárního útlumu. Obnoveno z: en.wikipedia.org
- Science Struck. (2018). Molární absorpce. Obnoveno z: sciencestruck.com
- Kolorimetrická analýza: (Beerův zákon nebo spektrofotometrická analýza). Obnoveno z: chem.ucla.edu
- Kerner N. (s.f.). Experiment II - Barva roztoku, absorbance a Beerův zákon. Obnoveno z: umich.edu
- Day, R., & Underwood, A. Kvantitativní analytická chemie (páté vydání). PEARSON Prentice Hall, p-472.
- Gonzáles M. (17. listopadu 2010). Absorpčnost Obnoveno z: quimica.laguia2000.com



Zatím žádné komentáře