
Odůvodnění, příprava a použití agaru XLD
The XLD agar nebo Xylosa Lysin Deoxycholátový agar je selektivní a diferenciální pevné kultivační médium pro izolaci enteropatogenů. Taylor navrhl agarový vzorec XL (Xylóza, Lysin) s cílem zlepšit izolaci rodu Shigella.
Poznamenal, že tento rod byl inhibován ve většině médií určených k izolaci enteropatogenů. Následně byl přidán deoxycholát sodný, thiosíran sodný a citronan amonný, aby se zvýšila jeho selektivita. Ukázalo se, že tento vzorec je vhodný jak pro izolaci Shigella, tak Salmonella.
XLD agar se skládá z kvasnicového extraktu, deoxycholátu sodného, xylózy, lysinu, laktózy, sacharózy, thiosíranu sodného, citronanu amonno-železitého, chloridu sodného, fenolové červeně a agaru. Ve většině bakteriologických laboratoří se ke studiu fekálních vzorků na Shigella a Salmonella používá duo XLD agar a SS agar..
Jiné laboratoře mimo jiné preferují kombinaci CHROMagar Salmonella a XLD agaru. Tyto dua lze připravit ve dvou Petriho miskách. Na jednu stranu umístí XLD agar a na druhou stranu druhé zvolené médium.
Rejstřík článků
- 1 Odůvodnění
- 1.1 - Nutriční síla
- 1.2 - Selektivita média
- 1,3 - Diferenciální výkon
- 1,4-Chlorid sodný, agar a fenolová červeň
- 2 Příprava
- 3 použití
- 3.1 Typy vzorků
- 3.2 Výsev a identifikační podmínky
- 4 Kontrola kvality
- 5 Závěrečné úvahy
- 6 Reference
Základ
-Výživná síla
XLD agar má kvasnicový extrakt, který slouží jako zdroj živin pro mikroorganismy, které se na tomto agaru vyvíjejí. Přítomnost sacharidů (xylóza, sacharóza a laktóza) navíc dodává energii bakteriím, které je mohou fermentovat.
-Selektivita média
Jako inhibiční látka obsahuje deoxycholát sodný; Tím se zabrání růstu grampozitivních bakterií, čímž se médium stane selektivním.
-Diferenční výkon
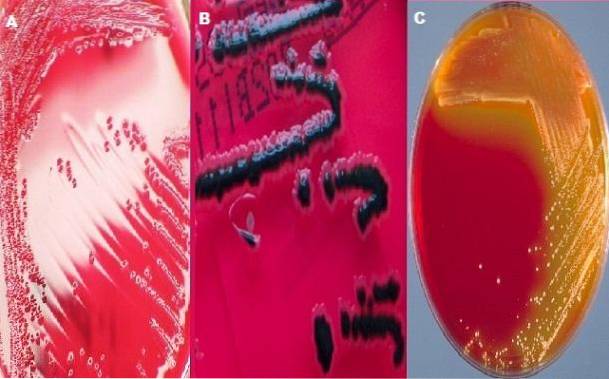
Typické kolonie Shigella
Jak již bylo uvedeno, XLD agar obsahuje xylózu; Tento sacharid je fermentován všemi bakteriemi, které v tomto médiu rostou, kromě rodu Shigella..
To je jedna z charakteristik, které jí dodávají její diferenciální charakter, protože kolonie Shigella se od ostatních odlišují vytvářením červených kolonií, zatímco ostatní bakterie produkují žluté kolonie..
Typické kolonie Salmonella
Rod Salmonella také fermentuje xylózu, původně vytvářející žluté kolonie. Po vyčerpání sacharidů xylózy však útočí na lysin pro svůj enzym lysin dekarboxylázu. Dekarboxylace lysinu generuje alkálie, které mění barvu kolonie a okolního média na původní červenou.
Toto chování provádí pouze Salmonella, protože koliformní bakterie, které dekarboxylátují lysin, nejsou schopné alkalizovat médium. Je to proto, že koliformní bakterie také fermentují přítomnou laktózu a sacharózu; proto je produkce kyselin velmi vysoká, takže v těchto bakteriích zůstává žlutá kolonie.
Je třeba poznamenat, že rod Salmonella nefermentuje sacharózu ani laktózu.
Výroba HdvaS
XLD agar také umožňuje detekci druhů Salmonella, které produkují H.dvaS; K tomu má zdroj síry představovaný thiosíranem sodným a reakční vývojku, kterou je citrát železito-amonný..
Ten reaguje s HdvaS (bezbarvý plyn) a tvoří nerozpustnou viditelnou černou sraženinu síranu železitého. V tomto smyslu budou vlastnosti kolonií salmonely červené s černým středem..
Je třeba poznamenat, že pro tvorbu reakce HdvaAno, je zapotřebí zásadité pH. Proto další Enterobacteriaceae, které tvoří HdvaS nemohou to udělat nebo to dělají špatně v tomto médiu, protože vysoká kyselost, kterou produkují při fermentaci přítomných sacharidů, brzdí nebo brání reakci.
-Chlorid sodný, agar a fenolová červeň
Nakonec chlorid sodný udržuje osmotickou rovnováhu; agar je tuhnoucí činidlo a fenolová červeň detekuje změny pH a mění barvu kolonií a média.
Příprava
Naváží se 55 g dehydratovaného média XLD a rozpustí se v 1 litru vody. Směs se zahřívá a míchá, dokud nedosáhne bodu varu. Nepřehřívejte, protože teplo poškozuje médium a vytváří sraženinu, která mění morfologii typických kolonií.
Toto médium nesmí být autoklávováno. Při rozpouštění musí být předán do vodní lázně o teplotě 50 ° C. Při chlazení by se mělo podávat přímo na sterilní Petriho misky. Lze je nalít do jednoduchých nebo dvojitých desek. Nechají se ztuhnout a až do použití se skladují v chladničce..
Před použitím temperujte. Jelikož se jedná o nesterilní médium, doporučuje se připravit jej těsně před datem jeho použití..
Konečné pH média by mělo být 7,4 ± 0,2. Barva připraveného média je oranžově červená, průsvitná, bez sraženiny..
Pokud máte agar na bázi xylózy a lysinu (XL), můžete přidat deoxycholát sodný, thiosíran sodný a citronan amonný. Tímto způsobem se získá vzorec agaru XLD.
Aplikace
XLD agar se používá k izolaci enteropatogenů, zejména rodu Shigella a sekundárně rodu Salmonella. Je užitečné pro hodnocení vzorků stolice, vody a potravin.
Druhy vzorků
Výkaly
Vzorky stolice lze zasít přímo na XLD agar, což umožňuje dobrou distribuci materiálu k získání izolovaných kolonií.
Pro zlepšení regenerace Salmonella lze XLD agar vysít z média pro obohacování Salmonella..
Jídlo
V případě potravin lze použít obohacovací bujóny pro Salmonella a Shigella. U Salmonella můžete použít mimo jiné seleničitý cystinový vývar, jasně zelený tetrathionátový vývar..
V případě Shigella může být obohacen o Shigella bujón s 0,5 µ / ml novobiocinu, inkubovaný při 42 ° ± 1 ° C po dobu 16-20 hodin.
Voda
Při analýze vody se mimo jiné doporučuje technika membránové filtrace a použití agaru XLD..
Podmínky setí a identifikace
Naočkované médium se inkubuje aerobně při 35 ° C po dobu 24 až 48 hodin..
Jsou pozorovány typické kolonie každého rodu, podezřelé kolonie by měly podstoupit biochemické testy pro jejich identifikaci.
QA
K vyhodnocení kontroly kvality média lze použít následující bakteriální kmeny: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Salmonella abony DSM 4224, Shigella flexneri ATCC 12022, Shigella sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495.
Rod Salmonella je charakteristický tím, že se v tomto středně červeném kolonii vyskytuje s černým středem nebo zcela černými koloniemi. Zatímco u rodu Shigella musí být kolonie červené, tj. Barva média.
V případě Escherichia coli očekává se úplná nebo částečná inhibice; pokud roste, kolonie jsou žluté. V následujících situacích Proteus mirabilis špatný růst se očekává u růžových kolonií s černým středem nebo bez něj. Nakonec rod Klebsiella vyroste jako žluté kolonie.
Závěrečné myšlenky
XLD agar je široce používán v bakteriologických laboratořích díky své vysoké účinnosti pro obnovu Shigella a má také dobrou výtěžnost rodu Salmonella.
Rall a kol. (2005) ve své práci s názvem „Vyhodnocení tří obohacovacích půd a pěti pevných médií pro detekci salmonely u drůbeže“ prokázali, že ze 3 testovaných klasických médií (jasně zelený agar, SS agar a XLD agar), XLD agar měl nejlepší míru zotavení.
Procenta výtěžnosti byla následující: 13,8% pro jasně zelený agar, 27,6% pro SS a 34,5% pro XLD. Byl překonán pouze chromogenním médiem Rambachovým agarem se 48% výtěžkem a CHROMagarem s 79,3%.
Reference
- Nemoci přenášené potravinami. Shigelóza. Dostupné na: anmat.gov.ar
- „XLD agar.“ Wikipedia, The Free Encyclopedia. 9. února 2019, 11:46 UTC. 10. dubna 2019, 19:25 wikipedia.org
- Laboratoře BBL. CHROMagar Salmonella / BD XLD agar (biplate). 2013 Dostupné na: bd.com
- Laboratoř Neogen. XLD agar. K dispozici na adrese: foodsafety.neogen
- Laboratoř Francisco Soria Melguizo. XLD agar. K dispozici na: http://f-soria.es/Inform
- Rall L, Rall R, Aragon C, Silva M. Vyhodnocení tří obohacovacích bujónů a pěti kultivačních médií pro detekci salmonely u drůbeže. Braz. J. Microbiol. 2005; 36 (2): 147-150. Dostupné z: scielo.br
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologická diagnostika. 12 ed. Redakční Panamericana S.A. Argentina.



Zatím žádné komentáře