
Struktura isopropylalkoholu, vlastnosti, syntéza a použití
The isopropylalkohol nebo isopropanol je organická sloučenina, jejíž chemický vzorec je CH3CHOHCH3 nebo (CH3)dvaCHOH. Patří do jedné z nejdůležitějších rodin v organické chemii: alkoholů, jak naznačuje její název..
Je to kapalná, bezbarvá, silně vonící, těkavá a hořlavá chemická sloučenina. Je to slabá kyselina a báze současně, podobně jako voda, v závislosti na pH roztoku a / nebo přítomnosti kyseliny nebo zásady silnější než je tato. Páry izopropylalkoholu způsobují velmi mírné podráždění sliznice nosu, krku a očí..
Isopropylalkohol se používá jako hlavní složka různých produktů ve farmaceutickém, chemickém, komerčním a domácím průmyslu. Díky svým antimikrobiálním vlastnostem je široce používán jako antiseptikum na kůži a sliznici a jako dezinfekční prostředek v inertních materiálech..
Je velmi užitečné jako rozpouštědlo, protože má nízkou toxicitu a také se používá jako aditivum do benzínu..
Stejně tak se jedná o surovinu pro syntézu dalších organických sloučenin nahrazením hydroxylové (OH) funkční skupiny. Tímto způsobem je tento alkohol velmi užitečný a univerzální pro získání dalších organických sloučenin; jako jsou alkoxidy, alkylhalogenidy a další chemické sloučeniny.
Rejstřík článků
- 1 Struktura isopropylalkoholu nebo isopropanolu
- 2 Fyzikální a chemické vlastnosti
- 2.1 Molekulová hmotnost
- 2.2 Fyzický vzhled
- 2.3 Zápach
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Hustota
- 2.7 Rozpustnost
- 2,8 pKa
- 2.9 Konjugovaná základna
- 2.10 Absorbance
- 3 Názvosloví
- 4 Syntéza
- 5 použití
- 5.1 Souhrnně
- 5.2 K čištění
- 5.3 Antimikrobiální látka
- 5.4 Medicína
- 5.5 Rozpouštědlo
- 6 Reference
Struktura isopropylalkoholu nebo isopropanolu
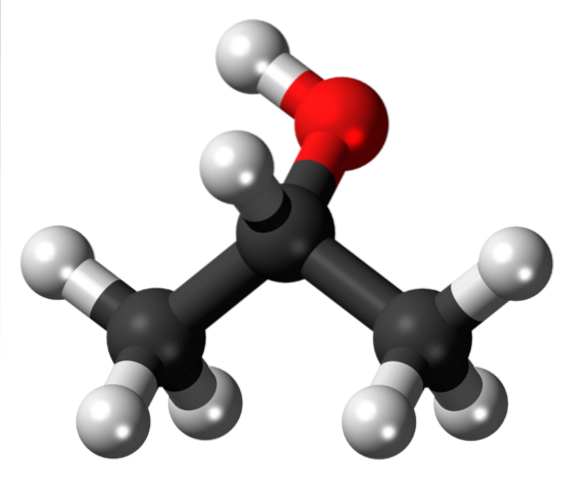
Horní obrázek ukazuje strukturu isopropylalkoholu nebo isopropanolu s modelem koulí a pruhů. Tři šedé koule představují atomy uhlíku, které tvoří isopropylovou skupinu připojenou k hydroxylu (červená a bílá koule).
Jako všechny alkoholy jsou strukturně vyrobeny z alkanu; v tomto případě propan. To dává alkoholu charakteristiku lipofilní (schopnost rozpouštět tuky vzhledem k jeho afinitě k nim). Je navázán na hydroxylovou skupinu (-OH), která na druhé straně dává struktuře hydrofilní charakteristiku.
Proto může isopropylalkohol rozpouštět mastnotu nebo skvrny. Všimněte si, že skupina -OH je navázána na střední uhlík (2., tj. Navázaný na dva další atomy uhlíku), což ukazuje, že tato sloučenina je sekundární alkohol.
Jeho bod varu je nižší než bod varu vody (82,6 ° C), což lze vysvětlit z propanového skeletu, který sotva může vzájemně interagovat pomocí londýnských disperzních sil; nižší než vodíkové vazby (CH3)dvaCHO-H - H-O-CH (CH3)dva.
Fyzikální a chemické vlastnosti
Molekulární váha
60,10 g / mol.
Fyzický vzhled
Kapalné a bezbarvé a hořlavé.
Zápach
Silný zápach
Bod tání
-89 ° C.
Bod varu
82,6 ° C.
Hustota
0,786 g / ml při 20 ° C.
Rozpustnost
Je rozpustný ve vodě a rozpustný v organických sloučeninách, jako je chloroform, benzen, ethanol, glycerin, ether a aceton. Je nerozpustný ve solných roztocích.
pKa
17
Konjugovaná základna
(CH3)dvaCHO-
Absorbance
Isopropylalkohol ve viditelném ultrafialovém spektru má maximální absorbanci při 205 nm.
Nomenklatura
V nomenklatuře organických sloučenin existují dva systémy: systém běžných jmen a mezinárodně standardizovaný systém IUPAC..
Isopropylalkohol odpovídá obecnému názvu, končící příponou -ico, před kterou je uvedeno slovo alkohol a názvem alkylové skupiny. Alkylová skupina je tvořena 3 atomy uhlíku, dvěma methylovými konci a jedním ve středu připojeným ke skupině -OH; tj. isopropylová skupina.
Isopropylalkohol nebo isopropanol má další názvy, jako je 2-propanol, sek-propylalkohol, mimo jiné; ale podle nomenklatury IUPAC se tomu říká propan-2-ol.
Podle této nomenklatury se jedná o první „propan“, protože uhlíkový řetězec obsahuje tři atomy uhlíku nebo je z něj tvořen.
Zadruhé, poloha skupiny OH je indikována na uhlíkovém řetězci pomocí čísla; v tomto případě je to 2.
Název končí na „ol“, který je charakteristický pro organické sloučeniny skupiny alkoholů, protože obsahují hydroxylovou skupinu (-OH).
Název isopropanol je IUPAC považován za nesprávný kvůli absenci uhlovodíkového isopropanu.
Syntéza
Reakce chemické syntézy isopropylalkoholu na průmyslové úrovni je v podstatě adiční reakce s vodou; tj. hydratace.
Výchozím produktem pro syntézu nebo získání je propen, do kterého se přidá voda. Propene CH3-CH = CHdva Jedná se o alken, uhlovodík získaný z ropy. Hydratací je vodík (H) nahrazen hydroxylovou skupinou (OH).
K alkenpropenu se za přítomnosti kyselin přidává voda za vzniku isopropanolového alkoholu..
Existují dva způsoby, jak ji hydratovat: přímý a nepřímý způsob prováděný za polárních podmínek, při kterém vzniká isopropanol..
CH3-CH = CHdva (Propen) => CH3CHOHCH3 (Isopropanol)
Při přímé hydrataci je propen v plynné nebo kapalné fázi hydratován kyselou katalýzou za vysokého tlaku.
Při nepřímé hydrataci reaguje propen s kyselinou sírovou za vzniku sulfátových esterů, které hydrolýzou produkují isopropylalkohol.
Isopropylalkohol se také získává hydrogenací acetonu v kapalné fázi. Po těchto procesech následuje destilace k oddělení alkoholu od vody za vzniku bezvodého isopropylalkoholu s výtěžkem přibližně 88%..
Aplikace
Isopropylalkohol má širokou škálu použití na chemické úrovni. Je užitečné pro výrobu dalších chemických sloučenin. Má řadu aplikací na průmyslové úrovni, pro čisticí zařízení, na lékařské úrovni, v domácích výrobcích a pro kosmetické použití..
Tento alkohol se používá mimo jiné v parfémech, barvách na vlasy, lacích, mýdlech, jak uvidíte níže. Jeho použití je hlavně a v zásadě vnější, protože jeho vdechování nebo požití je pro živé bytosti velmi toxické.
celkem
Z ní lze získat alkylhalogenidy obecným nahrazením bromu (Br) nebo chloru (Cl), funkční skupiny alkoholu (OH).
Provedením procesu oxidace isopropylalkoholu kyselinou chromovou může vznikat aceton. Může tvořit alkoxidy v důsledku reakce isopropylalkoholu s některými kovy, jako je draslík.
Pro čištění
Isopropylalkohol je ideální pro čištění a údržbu optických brýlí, jako jsou čočky a elektronická zařízení. Tento alkohol se rychle odpařuje, nezanechává zbytky ani stopy a při svých aplikacích ani při vnějším použití nepředstavuje toxicitu.
Antimikrobiální
Isopropanol má antimikrobiální vlastnosti, způsobuje denaturaci bakteriálních proteinů, mimo jiné rozpouští lipoproteiny buněčné membrány.
Jako antiseptikum se na pokožku a sliznice nanáší isopropylalkohol, který se rychle odpařuje a zanechává chladivý účinek. Používá se k provádění drobných operací, zavádění jehel, katétrů, mimo jiné invazivní procedury. Kromě toho se používá jako dezinfekční prostředek pro lékařské nástroje.
Lék
Kromě použití jako antimikrobiální látky je v laboratořích vyžadováno čištění, konzervace vzorků a extrakce DNA..
Tento alkohol je také velmi užitečný při přípravě farmakologických produktů. Isopropylalkohol se mísí s vonnými látkami a éterickými oleji a používá se v terapeutických sloučeninách k tření těla.
Solventní
Isopropylalkohol má schopnost rozpouštět mezi jinými chemickými sloučeninami některé oleje, přírodní pryskyřice, gumy, alkaloidy, ethylcelulózu.
Reference
- Carey, F. A. (2006). Organic Chemistry Sixth Edition. Nakladatelství Mc Graw Hill
- Morrison, R. a Boyd, R. (1990). Organická chemie. Páté vydání. Redakční Addison-Wesley Iberoamericana.
- PubChem. (2019). Isopropylalkohol. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Isopropylalkohol. Obnoveno z: en.wikipedia.org
- Wade, L. (5. dubna 2018). Isopropylalkohol. Encyclopaedia Britannica. Obnoveno z: britannica.com



Zatím žádné komentáře