
Historie, struktura, vlastnosti, použití berylia
The berylium Jedná se o kovový prvek, který patří do skupiny 2 nebo IIA periodické tabulky. Je to nejlehčí kov alkalických zemin ve skupině a je reprezentován symbolem Be. Jeho atom a kation jsou také menší než jeho kongenery (Mg, Ca, Sr ...).
Vzhledem ke své neobvyklé hustotě náboje se tento kov obvykle nevyskytuje izolovaně. Je známo asi 30 minerálů, mezi nimiž jsou: beryl (3BeOAldvaNEBO36SiOdva2HdvaO), bertrandit (4BeO.2SiOdva.2HdvaO), chrysoberyl (BeAldvaNEBO4) a fenaquita (BedvaAno4).

Emerald, drahokam, je variantou berylu. Čisté berylium však není tak nápadné; má světle šedavé odlesky (horní obrázek) a bylo jich dosaženo ve formě semen nebo pastilek.
Berylium má řadu charakteristických fyzikálních vlastností. Má nízkou hustotu; vysoké tepelné a elektrické vodivosti, jakož i jeho tepelná kapacita a odvod tepla; není to magnetický kov; a také má vhodnou kombinaci tuhosti a pružnosti.
Všechny tyto vlastnosti vedly k tomu, že berylium je kov s mnoha aplikacemi, od jeho použití ve slitinách s mědí pro výrobu nástrojů až po jeho použití v raketách, letadlech, automobilech, jaderných reaktorech, rentgenových zařízeních, rezonančních nukleárních magnetických, atd.
Berylium má 10 známých izotopů, od 5Být 14Být, být 9Buďte jediní stabilní. Stejně tak se jedná o velmi toxický kov, který zvláště ovlivňuje dýchací systém, takže jeho použití je omezené..
Rejstřík článků
- 1 Historie jeho objevu
- 2 Struktura berýlia
- 3 Elektronická konfigurace
- 4 Vlastnosti
- 4.1 Fyzický popis
- 4.2 Teplota tání
- 4.3 Bod varu
- 4.4 Hustota
- 4.5 Atomový poloměr
- 4.6 Kovalentní poloměr
- 4.7 Atomový objem
- 4.8 Měrné teplo
- 4.9 Teplo fúze
- 4.10 Odpařovací teplo
- 4.11 Elektronegativita
- 4.12 Standardní potenciál
- 4.13 Rychlost zvuku
- 4.14 Tepelná roztažnost
- 4.15 Tepelná vodivost
- 4.16 Chemické vlastnosti
- 5 Aplikace
- 5.1 Vývoj nástrojů
- 5.2 Tvorba zrcátek
- 5.3 V ionizujícím záření
- 5.4 V zařízeních generujících magnetismus
- 5.5 Jaderné reaktory
- 5.6 Kovový chránič
- 6 Kde je?
- 7 Rizika
- 8 Reference
Historie jeho objevu
Berylium bylo objeveno Louisem-Nicolasem Vauguelinem v roce 1798 jako složka minerálu beryl a křemičitan hlinitý a berylium.
Později se německému chemikovi Fredericovi Wöhlerovi v roce 1828 podařilo izolovat berylium reakcí draslíku s chloridem berylnatým v platinovém kelímku..
Souběžně a nezávisle francouzský chemik Antoine Bussy také dosáhl izolace berylia. Wöhler jako první navrhl pro kov název berylium.
To dostalo jeho současný název v roce 1957, protože to bylo dříve známé jako glucinium, kvůli sladké chuti některých jeho solí. Aby se však zabránilo záměně s jinými sloučeninami chutnajícími sladce as rostlinou zvanou glucin, bylo rozhodnuto změnit název na berylium..
Struktura berýlia
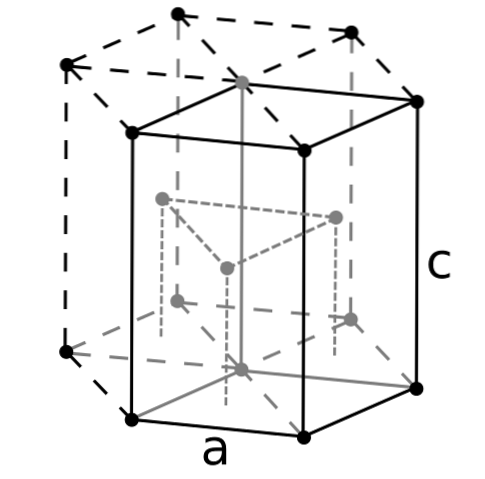
Berýlium, které je nejlehčí z kovů alkalických zemin, lze očekávat, že objem jeho atomů bude ze všech nejmenší. Atomy berýlia interagují navzájem prostřednictvím kovové vazby takovým způsobem, že jejich „moře elektronů“ a odpuzování mezi jádry formují strukturu výsledného krystalu..
Poté se vytvoří černé krystaly berylia. Tyto krystaly mají hexagonální strukturu (horní obrázek), kde každý atom Be má šest bočních sousedů a další tři v rovinách nahoře a dole..
Protože jsou krystaly černé, je užitečné si představit, že černé body hexagonální struktury jsou nahrazeny atomy berylia. Jedná se o jednu z nejkompaktnějších struktur, které může kov přijmout; a dává smysl, že velmi malé atomy Be jsou „vymačkané“ natolik, aby se zabránilo co nejmenšímu množství prázdných míst nebo počtu děr mezi nimi.
Elektronická konfigurace
1 sdva2 sdva
Což se rovná 4 elektronům, z nichž 2 jsou valenční. Pokud je elektron povýšen na orbitál 2p, budeme mít dva sp hybridní orbitaly. Ve sloučeninách berylia tedy mohou existovat lineární geometrie, X-Be-X; například izolovaná molekula BeCldva, Cl-Be-Cl.
Vlastnosti
Fyzický popis
Lesklá, křehká, ocelově šedá pevná látka.
Bod tání
1287 ° C.
Bod varu
2471 ° C.
Hustota
- 1,848 g / cm3 pokojová teplota.
- 1,69 g / cm3 do bodu tání (kapalný stav).
Atomové rádio
112 hod.
Kovalentní poloměr
90 hodin.
Atomový objem
5 cm3/ mol.
Specifické teplo
1 824 J / gmol při 20 ° C.
Teplo fúze
12,21 kJ / mol.
Odpařovací teplo
309 kJ / mol.
Elektronegativita
1,57 na Paulingově stupnici.
Standardní potenciál
1,70 V.
Rychlost zvuku
12 890 m / s.
Teplotní roztažnost
11,3 µm / m K při 25 ° C.
Tepelná vodivost
200 w / m K..
Chemické vlastnosti
Berylium je potaženo vrstvou oxidu berylnatého (BeO), která jej chrání na vzduchu při pokojové teplotě. K oxidaci berýlia dochází při teplotách nad 1 000 ° C, které vznikají jako produkty oxidu berylnatého a nitridu berylnatého.
Je také odolný vůči působení kyseliny dusičné 15 M. Rozpouští se však v kyselině chlorovodíkové a zásadách, jako je hydroxid sodný..
Aplikace
Výroba nástrojů
Berylium tvoří slitiny s mědí, niklem a hliníkem. Zejména slitina s mědí vyrábí nástroje s vysokou tvrdostí a odolností, které tvoří pouze 2% hmotnosti slitiny..
Tyto nástroje neprodukují při úderech železo jiskry, což umožňuje jejich použití v prostředích s vysokým obsahem hořlavých plynů..
Díky své nízké hustotě má nízkou hmotnost, což spolu s tuhostí umožňuje jeho použití v kosmických letadlech, raketách, raketách a letadlech. Slitina s beryliem byla použita při výrobě automobilových dílů. Používá se také při výrobě pružin.
Vzhledem k velké tvrdosti, kterou berylium propůjčuje svým slitinám, se používají u brzd vojenských letadel.
Výroba zrcadla
Berylium se používá při výrobě zrcadel kvůli své rozměrové stabilitě a schopnosti být vysoce leštěné. Tato zrcadla se používají v satelitech a v systémech řízení palby. Kromě toho se používají ve vesmírných dalekohledech.
V ionizujícím záření
Berylium je prvek s nízkou hustotou, takže jej lze považovat za transparentní pro rentgenové záření. Tato vlastnost umožňuje jeho použití při konstrukci oken trubek produkujících rentgenové záření, pro průmyslové použití a pro lékařskou diagnostiku..
Berýlium se také používá v oknech detektorů radioaktivních emisí..
V zařízení generujícím magnetismus
Mezi vlastnosti berýlia patří, že se nejedná o magnetický prvek. To umožňuje jeho použití při konstrukci předmětů ze zařízení pro magnetickou rezonanci, ve kterých jsou generována magnetická pole s vysokou intenzitou, minimalizující jakékoli rušení.
Jaderné reaktory
Díky své vysoké teplotě tání našel uplatnění v jaderných reaktorech a keramice. Berylium se používá jako moderátor jaderných reakcí a jako producent neutronů:
9Být + 4He (α) => 12C + n (neutron)
Odhaduje se, že pro jeden milion atomů berylia, které jsou bombardovány částicemi α, se vyprodukuje až 30 milionů neutronů. Právě tato jaderná reakce umožnila objev neutronu.
James Chadwick bombardoval atomy berýlia částicemi α (He). Výzkumník pozoroval uvolňování subatomárních částic bez elektrického náboje, což vedlo k objevu neutronů.
Kovový chránič
Přidání množství berýlia na povrch kovů, které lze oxidovat, jim poskytuje určitou ochranu. Například je snížena hořlavost hořčíku a prodloužen lesk slitin stříbra.
Kde se to nachází?
Beryl se nachází v pegmatitu, který je spojován se slídou, živcem a křemenem. Použitím flotační techniky se oddělí směs berylu a živce. Poté se živce a beryl koncentrují a podrobí ošetření chlornanem vápenatým..
Po následném zpracování kyselinou sírovou a sulfonátem draselným se pomocí zředění dosáhne flotace berylu, který jej oddělí od živce..
Beryl je zpracován fluorosilikátem sodným a sodou při 770 ° C za vzniku fluorobytanu sodného, oxidu hlinitého a oxidu křemičitého. Hydroxid berylnatý se poté vysráží z roztoku fluoroberylátu sodného hydroxidem sodným.
Fluorid berylnatý se tvoří reakcí hydroxidu berylnatého s fluorovodíkem amoniakem za vzniku tetrafluroberylátu amonného. To se zahřívá za vzniku fluoridu berylnatého, který se za horka zpracovává hořčíkem, aby se izolovalo berylium..
Rizika
Berylium jako jemně rozmělněný kov ve formě roztoků, suchého prášku nebo kouře je velmi toxický a může způsobit dermatitidu. Největší toxicita je však vyvolána vdechováním.
Zpočátku může berýlium vyvolat přecitlivělost nebo alergii, která se může vyvinout v beryliózu nebo chronickou chorobu berylium (CBD). Jedná se o závažné onemocnění charakterizované snížením kapacity plic.
Akutní onemocnění je vzácné. U chronických onemocnění se granulomy tvoří v celém těle, zejména v plicích. Chronická berylióza způsobuje progresivní dušnost, kašel a celkovou slabost (astenie).
Akutní berylliosis může být fatální. U beryliózy dochází k progresivní ztrátě respiračních funkcí, protože dochází k překážce v proudění plynů v dýchacím traktu a sníženému okysličování arteriální krve.
Reference
- Královská společnost chemie. (2019). Berýlium. Obnoveno z: rsc.org
- Národní centrum pro biotechnologické informace. (2019). Berýlium. Databáze PubChem. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Helmenstine, Anne Marie, Ph.D. (15. března 2019). Fakta o berýliu. Obnoveno z: thoughtco.com
- Wikipedia. (2019). Berýlium. Obnoveno z: en.wikipedia.org
- Lenntech B.V. (2019). Beryllium-Be. Obnoveno z: lenntech.com
- Materio Corporation. (2019). Další informace o prvku berylium Obnoveno z: beryllium.com
- D. Michaud. (2016, 12. dubna). Problém se zpracováním a extrakcí berýlia. 911 Metalurg. Obnoveno z: 911metallurgist.com
- Timothy P. Hanusa. (5. ledna 2016). Berýlium. Encyklopedie Britannica. Obnoveno z: britannica.com
- Lee S. Newman. (2014). Berylium. Příručka MSD. Obnoveno z: msdmanuals.com


Zatím žádné komentáře