
Vlastnosti, syntéza a použití bromovodíku (HBr)

The bromovodík, chemická sloučenina vzorce HBr, je to rozsivková molekula s kovalentní vazbou. Sloučenina je klasifikována jako halogenovodík, což je bezbarvý plyn, který po rozpuštění ve vodě vytváří kyselinu bromovodíkovou a při teplotě místnosti se nasytí 68,85% hmotn./hmotn..
Vodné roztoky v množství 47,6% hmotn./hmotn. Vytvářejí azeotropní směs s konstantní teplotou varu při teplotě 124,3 ° C. Méně koncentrované vroucí roztoky uvolňují H2O, dokud se nedosáhne složení azeotropické směsi s konstantní teplotou varu..
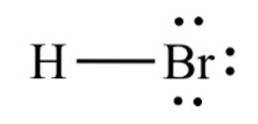
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 Reaktivita a nebezpečí
- 3 Zacházení a skladování
- 4 Syntéza
- 5 použití
- 6 Reference
Fyzikální a chemické vlastnosti
Bromid vodíku je bezbarvý plyn při pokojové teplotě s kyselým, dráždivým zápachem. Sloučenina je stabilní, ale při vystavení vzduchu nebo světlu postupně ztmavne, jak je znázorněno na obrázku 2 (National Center for Biotechnology Information, S.F.).

Má molekulovou hmotnost 80,91 g / mol a hustotu 3,307 g / l, díky čemuž je těžší než vzduch. Plyn kondenzuje a vytváří bezbarvou kapalinu s bodem varu -66,73 stupňů Celsia.
Při dalším ochlazování kapalina ztuhne a získá se bílé krystaly, jejichž teplota tání je -86,82 ° C a hustota 2,603 g / ml (Egon Wiberg, 2001). Vzhled těchto krystalů je znázorněn na obrázku 3.

Vazebná vzdálenost mezi bromem a vodíkem je 1,414 angstromů a jejich disociační energie je 362,5 kJ / mol..
Bromovodík je rozpustnější ve vodě než chlorovodík, 221 g lze rozpustit ve 100 ml vody při teplotě 0 stupňů Celsia, což odpovídá objemu 612 litrů tohoto plynu na každý litr vody. Je také rozpustný v alkoholu a jiných organických rozpouštědlech.
Ve vodném roztoku (kyselina bromovodíková) jsou kyselé vlastnosti HBr dominantní (jako je tomu v případě HF a HCl) a ve vazbě mezi vodíkem a halogenem jsou slabší v případě bromovodíku než v chlorovodíku.
Pokud tedy prochází chlór bromovodíkem, je pozorována tvorba hnědých par charakteristických pro molekulární brom. Reakce, která to vysvětluje, je následující:
2HBr + Cl2 → 2HCl + Br2
To naznačuje, že bromovodík je silnějším redukčním činidlem než chlorovodík a že chlorovodík je lepším oxidačním činidlem..
Bromovodík je bezvodá silná kyselina (bez vody). Rychle a exotermicky reaguje s bázemi všeho druhu (včetně aminů a amidů).
Exotermicky reaguje s uhličitany (včetně vápence a stavebních materiálů obsahujících vápenec) a hydrogenuhličitany za vzniku oxidu uhličitého.
Reaguje se sulfidy, karbidy, boridy a fosfidy za vzniku toxických nebo hořlavých plynů.
Reaguje s mnoha kovy (včetně hliníku, zinku, vápníku, hořčíku, železa, cínu a všech alkalických kovů) za vzniku hořlavého plynného vodíku.
Násilně reagujte pomocí:
- anhydrid kyseliny octové
- 2-aminoethanol
- hydroxid amonný
- fosfid vápenatý
- kyselina chlorsulfonová
- 1,1-difluorethylen
- ethylendiamin
- ethylenimin
- dýmavá kyselina sírová
- kyselina chloristá
- b-propriolakton
- OXID propylenu
- chloristan stříbrný
- Fosfid uranu (IV)
- vinylacetát
- karbid vápníku
- karbid rubidia
- acetylid cesný
- rubidiumacetylid
- borid hořečnatý
- síran rtuťnatý
- fosfid vápenatý
- karbid vápníku (Chemical Datasheet, 2016).
Reaktivita a nebezpečí
Bromovodík je klasifikován jako žíravá a dráždivá sloučenina. Je extrémně nebezpečný při kontaktu s pokožkou (dráždivý a leptavý) a očima (dráždivý) a při požití a vdechování (dráždivý pro plíce).
Sloučenina se skladuje v tlakových nádobách na zkapalněný plyn. Dlouhodobé vystavení ohni nebo intenzivnímu teplu může mít za následek násilné prasknutí tlakové nádoby, které může být uvolněno a uvolňovat dráždivé toxické výpary..
Dlouhodobé vystavení nízkým koncentracím nebo krátkodobé vystavení vysokým koncentracím může mít za následek nepříznivé účinky na zdraví při vdechování..
Tepelným rozkladem bezvodého bromovodíku vznikají toxické plyny bromu. Pokud reaguje uvolňováním vodíku, může se stát hořlavým. Při kontaktu s kyanidem vznikají toxické plyny kyanovodíku.
Vdechnutí způsobuje silné podráždění nosu a horních cest dýchacích, což může způsobit poranění plic..
Požití způsobuje popáleniny v ústech a žaludku. Kontakt s očima způsobuje silné podráždění a popáleniny. Kontakt s pokožkou způsobuje podráždění a popáleniny.
Pokud tato chemická látka v roztoku přijde do styku s očima, měla by být okamžitě propláchnuta velkým množstvím vody, občas nadzvednutým dolním a horním víčkem..
Při práci s touto chemikálií by se neměly používat kontaktní čočky. Pokud je oční tkáň zmrzlá, okamžitě vyhledejte lékařskou pomoc..
Pokud tkáň není zmrzlá, okamžitě a důkladně vyplachujte oči velkým množstvím vody po dobu nejméně 15 minut, příležitostně zvedněte dolní a horní víčka..
Pokud podráždění, bolest, otok nebo slzení přetrvávají, vyhledejte co nejdříve lékařskou pomoc..
Pokud tato chemická látka v roztoku přijde do styku s pokožkou a nezpůsobí omrzliny, okamžitě opláchněte znečištěnou pokožku vodou.
Pokud se tato chemikálie dostane na oděv, okamžitě oděv svlékněte a omyjte pokožku vodou.
Pokud dojde k omrzlinám, okamžitě vyhledejte lékařskou pomoc. Neměli byste postižené oblasti otírat nebo opláchnout vodou. Aby se zabránilo dalšímu poškození textilií, neměli byste se snažit odstranit zmrzlý oděv z mrazivých oblastí..
Pokud dojde k vdechnutí velkého množství této chemické látky, měla by být exponovaná osoba okamžitě přemístěna na čerstvý vzduch. Pokud se dýchání zastavilo, proveďte resuscitaci z úst do úst. Oběť by měla být udržována v teple a v klidu a měla by být co nejdříve vyhledána lékařská pomoc..
Pokud byla tato chemická látka v roztoku spolknuta, okamžitě vyhledejte lékařskou pomoc.
Manipulace a skladování
Lahvičky s bromovodíkem by měly být skladovány na chladném a dobře větraném místě. Jeho manipulace musí být zajištěna odpovídajícím větráním. Mělo by se uchovávat pouze tehdy, když teplota nepřesáhne 52 stupňů Celsia.
Kontejnery by měly být pevně zajištěny ve svislé poloze, aby nedošlo k jejich pádu nebo nárazu. Nainstalujte také ochrannou čepičku ventilu, pokud je k dispozici, pevně na místo rukou, stejně jako skladujte plné a prázdné nádoby samostatně (praxeair inc., 2016).
Při manipulaci s produktem pod tlakem je třeba používat řádně navržené potrubí a zařízení, aby odolaly tlakům. Nikdy nepracujte na přetlakovém systému a nepoužívejte v potrubí zařízení zabraňující zpětnému toku. Plyny mohou způsobit rychlé udušení v důsledku nedostatku kyslíku.
Skladování a používání s odpovídajícím větráním je důležité. Pokud dojde k netěsnosti, uzavřete ventil nádoby a bezpečně a ekologicky nezavřete systém. Poté netěsnost opravte. Nikdy neumisťujte nádobu na místo, kde může být součástí elektrického obvodu.
Při manipulaci s lahvemi byste měli nosit kožené ochranné rukavice a vhodnou obuv. Musí být chráněny a za tímto účelem je třeba se jim vyhnout, táhnout, převrátit nebo sklouznout..
Při pohybu válce by měl být odnímatelný kryt ventilu vždy na svém místě. Nikdy se nepokoušejte zvedat válec za jeho kryt, který slouží výhradně k ochraně ventilu..
Při přemisťování válců, i na krátké vzdálenosti, používejte vozík (vozík, ruční vozík atd.) Určený k přepravě válců.
Do otvorů v krytu by nikdy neměl být vložen předmět (např. Klíč, šroubovák, páčidlo), protože by to mohlo poškodit ventil a způsobit netěsnost..
Nastavitelný páskový klíč se používá k odstranění příliš těsných nebo zrezivělých víček. Ventil by se měl otevírat pomalu a pokud to není možné, přestaňte jej používat a kontaktujte svého dodavatele. Samozřejmě musí být ventil na nádobě po každém použití uzavřen..
Uvedený kontejner musí být uzavřený, i když je prázdný. Plamen nebo lokalizované teplo by nikdy nemělo být aplikováno přímo na jakoukoli část nádoby. Vysoké teploty mohou poškodit nádobu a způsobit předčasné selhání přetlakového zařízení, které odvzdušní obsah nádoby (praxeair inc., 2016).
Syntéza
Plynný bromovodík lze v laboratoři vyrábět bromací tetralinu (1,2,3,4-tetrahydronaftalenu). Nevýhodou je, že se ztrácí polovina bromu. Výtěžek je přibližně 94%, nebo 47% bromu končí jako HBr.
C10H12 + 4 Brdva → C.10H8Br4 + 4 HBr
Plynný bromovodík lze také syntetizovat v laboratoři reakcí koncentrované kyseliny sírové s bromidem sodným..
NaBr (s) + HdvaSW4 → HBr (g) + NaHSO4
Nevýhodou tohoto způsobu je, že velká část produktu se ztrácí oxidací přebytkem kyseliny sírové za vzniku bromu a oxidu siřičitého..
2 HBr + HdvaSW4 → Brdva + SWdva + 2 hdvaNEBO
Bromovodík lze připravit v laboratoři reakcí mezi čištěným plynným vodíkem a bromem. To je katalyzováno platinovým azbestem a provádí se v křemenné trubici při 250 ° C.
Brdva + Hdva[Pt] → 2 HBr
Bezvodý bromovodík lze také v malém měřítku vyrobit termolýzou trifenylfosfoniumbromidu v xylenu pod zpětným chladičem..
HBr lze získat metodou červeného fosforu. Nejprve se do vodního reaktoru přidá červený fosfor a později pomalu za míchání brom a reakce kyseliny bromovodíkové a kyseliny fosforité sedimentací, filtrací a získanou destilací bude kyselina bromovodíková..
P4+6 Brdva+12 hdvaO → 12 HBr + 4 H3PO3
Bromovodík připravený výše uvedenými způsoby může být kontaminován Brdva, které lze odstranit průchodem plynu roztokem fenolu v tetrachlormethanu nebo jiném vhodném rozpouštědle při pokojové teplotě za vzniku 2, 4, 6-tribromfenolu a tím generování více HBr.
Tento proces lze také provádět pomocí vysokoteplotních měděných třísek nebo měděné gázy (Hydrogen: bromovodík, 1993-2016).
Aplikace
HBr se používá při výrobě organických bromidů, jako je methylbromid, bromethan atd., A anorganických, jako je bromid sodný, bromid draselný, bromid lithný a bromid vápenatý atd..
Používá se také ve fotografických a farmaceutických aplikacích nebo k syntéze sedativ a anestetik. Dále se používá v průmyslovém sušení, povrchové úpravě textilu, nátěrových prostředcích, povrchových úpravách a protipožárních prostředcích..
Sloučenina se také používá k leptání polysilikonových desek pro výrobu počítačových čipů (Interscan Corporation, 2017).
Bromovodík je dobrým rozpouštědlem pro některé rudy kovů, které se používají při rafinaci vysoce čistých kovů.
V ropném průmyslu se používá jako separace alkoxy a fenoxy sloučenin a jako katalyzátor pro oxidaci cyklických uhlovodíků a řetězových uhlovodíků na ketony, kyselinu nebo peroxid. Používá se také v syntetických barvivech a koření..
Pro leptání a čištění polovodičových surovin se používá vysoce kvalitní plyn HBr (SHOWA DENKO K.K, n.d.).
Tato sloučenina se používá jako analytické činidlo při stanovení síry, selenu, vizmutu, zinku a železa pro separaci cínu od arsenu a antimonu. Je to alkylační katalyzátor a redukční činidlo používané v organické syntéze.
Bromovodík lze použít k výrobě kyseliny bromovodíkové. Kyselina bromovodíková je velmi silná minerální kyselina, silnější než kyselina chlorovodíková.
HBr je vysoce reaktivní a korozivní pro většinu kovů. Kyselina je běžným činidlem v organické chemii a používá se k oxidaci a katalýze. Je také účinný při těžbě určitých kovových minerálů (Hydrogen bromide, 2016).
Reference
- Interscan Corporation. (2017). Přístroje pro monitorování bromovodíku a bromovodíku. Obnoveno z gasdetection.com.
- Chemický datový list. (2016). Získáno z HYDROGEN BROMIDE, ANHYDROUS: cameochemicals.noaa.gov.
- Egon Wiberg, N. W. (2001). Anorganická chemie. Akademický tisk.
- Bromovodík. (2016). Obnoveno z ChemicalBook.
- Vodík: bromovodík. (1993-2016). Citováno z WebElements.
- Bezpečnostní list materiálu Bromovodík. (2005, 9. října). Obnoveno z sciencelab.com.
- Národní centrum pro biotechnologické informace. (S.F.). Složená databáze PubChem; CID = 260. Citováno z pubchem.ncbi.nlm.nih.gov.
- praxair inc. (2016, 17. října). Bezvodý bromovodík Bezpečnostní list P-4605. Obnoveno z praxeair.com.
- SHOWA DENKO K.K. (s.f.). bromovodík. Citováno z www.sdk.co.jp.


Zatím žádné komentáře