
Odůvodnění, příprava a použití fosfátového pufru (PBS)
The fosfátový pufr, BPS nebo fyziologický roztok fosfátového pufru Jedná se o pufrovaný a izotonický roztok, jehož funkcí je udržovat pH a osmotický tlak co nejblíže přirozenému biologickému (fyziologickému) prostředí. Zkratka PBS znamená fosfátem pufrovaný fyziologický roztok..
PH a osmolarita jsou dva velmi důležité aspekty, které musí být kontrolovány určitými laboratorními protokoly. V případě pH je nezbytné, aby bylo kontrolováno, zejména u biochemických reakcí, protože ty se mohou lišit nebo nemusí být prováděny, pokud jsou reaktanty při nevhodném pH.

Mezitím je kontrola osmolarity nezbytná, zejména při práci s živými buňkami, protože plazmatické membrány buněk reagují podle koncentrace rozpuštěných látek, ve kterých se nacházejí..
Pokud jsou buňky přeneseny do hypertonického média, dehydratují se, protože vodní gradient bude transportován na stranu, kde je vyšší koncentrace rozpuštěných látek. Pokud jsou naopak buňky umístěny do hypotonického média, budou buňky absorbovat kapalinu, dokud nebudou lyžovány..
Proto se PBS pufr používá pro laboratorní protokoly, které vyžadují údržbu buněk. in vitro, tímto způsobem nebudou buňky poškozeny.
PBS je tvořen kombinací solí, jako je chlorid sodný, fosforečnan sodný, chlorid draselný a fosforečnan draselný. Složení PBS se může lišit v závislosti na protokolu..
Rejstřík článků
- 1 Odůvodnění
- 2 Příprava
- 2.1 - Zásobní roztok fosfátového pufru fyziologický roztok (PBS 10X)
- 2,2-Pufrovaný fosfátový solný roztok (1X PBS)
- 2.3 Řešení pro úpravu pH
- 3 použití
- 4 Omezení
- 5 Reference
Základ
Funkcí solného fosfátového pufru je v zásadě udržovat konstantní fyziologické pH společně s koncentrací elektrolytu podobnou koncentraci v těle..
V tomto prostředí jsou buňky schopné zůstat stabilní, protože jsou co nejvíce simulovány fyziologické podmínky..
V případě potřeby lze k původnímu PBS přípravku přidat další sloučeniny, například přidání EDTA do pufru je užitečné pro promývání červených krvinek v testu zkřížené inkompatibility..
EDTA zabraňuje tomu, aby frakce komplementu C1 přítomná v séru byla štěpena a lyžována na červené krvinky, to znamená, že se vyhýbá falešným výsledkům nekompatibility. EDTA navíc pomáhá disociovat buňky.
Příprava
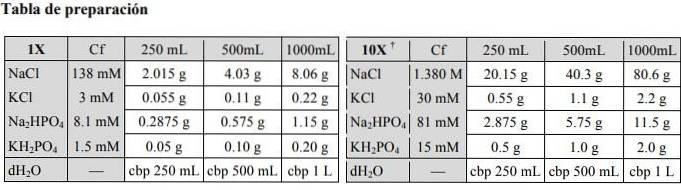
Množství solí, které je třeba zvážit pro přípravu fyziologického roztoku pufrovaného fosfátem PBS, bude záviset na množství, které je třeba připravit:
-Zásobní fyziologický roztok pufrovaný fosfáty (10X PBS)
Pro jeden litr roztoku:
Vážit:
80,6 g NaCl,
2,2 g KCl,
11,5 g NadvaHPO4,
2,0 g KHdvaHPO4
Technika přípravy
Vložte těžké soli do kádinky, přidejte dostatek vody (80%) a míchejte na míchací desce magnetickou tyčí, dokud se soli nerozpustí..

Filtrujte, abyste odstranili nerozpuštěné částice. Použijte filtry s póry 0,45 µm. Autoklávujte a asepticky distribuujte v digestoři s laminárním prouděním ve skleněných nádobách s víčky.
10x roztok (koncentrovaný) neupravuje pH. Úprava se provádí jednou naředěným na koncentraci 1X PBS pufru (ředění 1:10).
-Fosfátový pufrovací roztok (1X PBS)
1X PBS lze připravit přímo, přičemž se zváží odpovídající množství každé soli, nebo se může připravit zředěním zásobního roztoku (1:10) sterilní destilovanou vodou..
-Chcete-li přímo připravit jeden litr fyziologického roztoku pufrovaného 1X PBS fosfátem, zvažte:
8,06 g NaCl,
0,22 g KCl,
1,15 g NadvaHPO4,
0,20 g KHdvaHPO4
Technika přípravy
Postupujte, jak je vysvětleno pro koncentrovaný roztok. Následně musí být upraveno pH. Za tímto účelem změřte pH a v závislosti na výsledku použijte kyselinu (HCl) nebo bázi (NaOH) ke snížení nebo zvýšení pH podle potřeby, dokud není 7,4.
Kyselina nebo báze se přidávají po kapkách, přičemž se pomocí pH metru sleduje hodnota pH roztoku. Filtrujte, autoklávujte a asepticky rozdělte podle potřeby do kónických zkumavek nebo nádob.
-Příprava 1X PBS z 10X zásobního roztoku:
Proveďte ředění 1:10. Například pro přípravu 1 litru 1X PBS odměřte 100 ml zásobního roztoku a přidejte 700 ml sterilní destilované vody. Upravte pH a doplňte množství vody až na 1 000 ml.
Připravený PBS pufr je bezbarvý a transparentní.
Denní PBS lze skladovat při pokojové teplotě a zbytek v chladničce.
.Řešení pro úpravu pH
HCl
Pro 100 ml 1 molární HCL (kyselina chlorovodíková).
Odměřte 91 ml destilované vody a umístěte ji do 250 ml kádinky.
Odměřte 8,62 ml koncentrované HCl a přidávejte jej pomalu do kádinky s vodou (nikdy to neprovádějte obráceně). Při manipulaci se silnými kyselinami (vysoce korozivní látky) přijměte příslušná opatření pro biologickou bezpečnost..
Míchejte po dobu 5 minut, nejlépe pomocí míchací desky s magnetickou tyčí uvnitř sklenice. Přeneste do 100 ml balónku a doplňte na 100 ml HdvaNebo destilovaný.
NaOH
Pro 100 ml NaOH (hydroxid sodný) 10 mol.
Odměřte 40 ml destilované vody a vložte ji do 250 ml kádinky. Odměří se 40 g NaOH a přidá se do vody. Promíchejte pomocí míchací desky s magnetickou tyčí uvnitř sklenice.
Přeneste do odměrné baňky na 100 ml a doplňte po značku destilovanou vodou. Dodržujte předpisy o biologické bezpečnosti, protože tato reakce je exotermická (uvolňuje energii ve formě tepla).
Chcete-li připravit další množství fyziologického roztoku fosfátu, podívejte se do následující tabulky:
Aplikace
Používá se hlavně v buněčné biologii, imunologii, imunohistochemii, bakteriologii, virologii a výzkumných laboratořích.
Je ideální pro promývání buněk centrifugací (červené krvinky), promývání jednovrstvých buněk, technikami spektroskopické elipsometrie, kvantifikací bakteriálních biofilmů, udržováním buněčných kultur pro viry, jako promývací roztok technikou nepřímé imunofluorescence. A v technikách charakterizace monoklonálních protilátek.
Používá se také k přepravě buněk nebo tkání jako ředidlo pro počítání buněk, k přípravě buněčných enzymů (trypsin), jako ředidlo pro metodu vysušení biomolekul a k přípravě dalších reagencií..
Na druhou stranu Martin a kol. V roce 2006 prokázali, že PBS je užitečný ve forenzních vědeckých laboratořích, konkrétně při získávání spermií z vaginálních nátěrů nebo při regeneraci vaginálních buněk z nátěrů penisu. Tímto způsobem lze zjistit, zda došlo k sexuálnímu vztahu.
Omezení
-Některé PBS pufry obsahují jako konzervační látku látku zvanou azid sodný. Při styku s olovem nebo mědí může tato sloučenina vytvářet výbušné látky. Z tohoto důvodu je třeba při likvidaci tohoto činidla do odpadu věnovat zvláštní pozornost. Pokud je zlikvidován tímto způsobem, musí se přidat velké množství vody, aby se co nejvíce zředilo..
-Zinek by se neměl přidávat do fosfátového pufru, protože způsobuje srážení některých solí.
-Wangen et al. V roce 2018 zjistili, že použití PBS nebylo vhodné k promývání buněk primární akutní myeloidní leukémie (AML) extrahovaných z periferní krve, a to díky skutečnosti, že mnoho buněk je ztraceno lýzou s velkým poklesem proteinového materiálu.
Zjistili proto, že primární AML buňky by neměly být po skladování v kapalném dusíku promyty PBS..
Reference
- Coll J. (1993). Diagnostické techniky ve virologii. Ed Díaz de Santos. 360 str
- Rodríguez M, Ortiz T. Buněčná kultura. Změna média. Katedra normální a patologické cytologie a histologie Univerzita v Seville. K dispozici na personal.us.es
- Příprava fyziologického roztoku pufrovaného fosfáty (PBS). (2008). Standardní operační postupy (SOP) Laboratoř virové a lidské genomiky UASLP Lékařská fakulta. Dostupné na: genomica.uaslp.mx
- „Fosfátový pufrovací roztok.“ Wikipedia, The Free Encyclopedia. 3. dubna 2019, 19:36 UTC. 13. dubna 2019, 02:57 en.wikipedia.org.
- Pietrasanta L, Von-Bilderling C. Témata v molekulární biofyzice. K dispozici na: users.df.uba.ar
- Rediar. Manuál. PBS + EDTA. K dispozici na: felsan.com.ar
- Martin NC, Pirie AA, Ford LV, Callaghan CL, McTurk K, Lucy D, Scrimger DG. Použití fyziologického roztoku pufrovaného fosfáty k izolaci buněk a spermií z výtěrů. Sci spravedlnost. 2006; 46 (3): 179-84. K dispozici v: ncbi.nlm.nih.gov
- Wangen R, Aasebø E, Trentani A, et al. Metoda konzervace a promývání solným roztokem pufrovaným fosfáty ovlivňují protein akutní myeloidní leukémie. Int J Mol Sci. 2018; 19 (1): 296. K dispozici v: ncbi.nlm.nih.gov
- Martínez R, Gragera R. (2008). Teoretické a praktické základy histochemie. Nejvyšší rada pro vědecké výzkumy. Madrid. Dostupné na: books.google.co.ve



Zatím žádné komentáře