
Struktura oxidu železa, vlastnosti, názvosloví, použití
A oxid železa Je to kterákoli ze sloučenin vytvořených mezi železem a kyslíkem. Vyznačují se tím, že jsou iontové a krystalické a leží rozptýleny v důsledku eroze jejich minerálů, tvořících půdy, rostlinnou hmotu a dokonce i vnitřek živých organismů..
Je to pak jedna z rodin sloučenin, které převládají v zemské kůře. Co přesně jsou? Dosud je známo šestnáct oxidů železa, většina z nich přírodního původu a další syntetizované za extrémních tlakových nebo teplotních podmínek..

Část práškového oxidu železitého je znázorněna na obrázku výše. Jeho charakteristická červená barva pokrývá železo různých architektonických prvků v tzv. Rzi. Podobně je pozorován na svazích, horách nebo půdách, ve směsi s mnoha dalšími minerály, jako je žlutý prášek goethitu (α-FeOOH).
Nejznámějšími oxidy železa jsou hematit (α-FedvaNEBO3) a maghemit (ϒ- FedvaNEBO3), oba polymorfy oxidu železitého; a v neposlední řadě magnetit (Fe3NEBO4). Jejich polymorfní struktury a jejich velká povrchová plocha z nich činí zajímavé materiály jako sorbenty nebo pro syntézu nanočástic se širokým využitím..
Rejstřík článků
- 1 Struktura
- 1.1 Polymorfismus
- 1.2 Strukturální vazby
- 2 Vlastnosti
- 3 Názvosloví
- 3.1 Systematická nomenklatura
- 3.2 Skladová nomenklatura
- 3.3 Tradiční nomenklatura
- 4 použití
- 4.1 Nanočástice
- 4.2 Pigmenty
- 5 Reference
Struktura
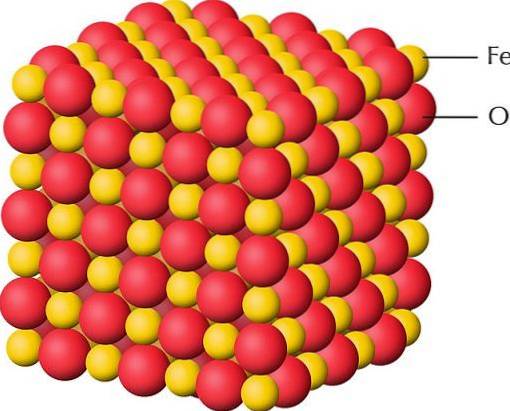
Horní obrázek je znázorněním krystalové struktury FeO, jednoho z oxidů železa, kde má železo valenci +2. Červené koule odpovídají aniontům Odva-, zatímco žluté k Fe kationůmdva+. Všimněte si také, že každá víradva+ je obklopen šesti Odva-, formování oktaedrické jednotky koordinace.
Strukturu FeO lze proto „rozpadnout“ na jednotky FeO.6, kde centrální atom je Fedva+. V případě oxyhydroxidů nebo hydroxidů je oktaedrickou jednotkou FeO3(ACH)3.
V některých strukturách, místo osmistěnu, jsou čtyřboké jednotky, FeO4. Z tohoto důvodu jsou struktury oxidů železa obvykle reprezentovány oktaédry nebo čtyřstěny s centry železa..
Struktury oxidů železa závisí na podmínkách tlaku nebo teploty, na poměru Fe / O (tj. Kolik kyslíků je na železo a naopak) a na valenci železa (+2, +3 a, velmi zřídka u syntetických oxidů, +4).
Obecně platí, že objemné anionty Odva- jsou zarovnané formující se listy, jejichž otvory obsahují Fe kationtydva+ o víru3+. Existují tedy oxidy (například magnetit), které mají žehličky s oběma valencemi.
Polymorfismus
Oxidy železa představují polymorfismus, tj. Různé struktury nebo krystalové uspořádání pro stejnou sloučeninu. Oxid železitý, FedvaNEBO3, má až čtyři možné polymorfy. Hematit, α-FedvaNEBO3, je nejstabilnější ze všech; následovaný maghemity, ϒ- FaithdvaNEBO3, a syntetickým p-FedvaNEBO3 a ε- FedvaNEBO3.
Všichni mají své vlastní typy krystalových struktur a systémů. Poměr 2: 3 však zůstává konstantní, takže existují tři anionty Odva- za každé dva Fe kationty3+. Rozdíl spočívá v tom, jak jsou umístěny oktaedrické jednotky FeO.6 ve vesmíru a jak jste se dali dohromady.
Strukturální vazby

Oktaedrické jednotky FeO6 lze zobrazit pomocí výše uvedeného obrázku. V rozích osmistěnu je O.dva-, zatímco v jejím středu je Víradva+ o víru3+(v případě FedvaNEBO3). Způsob, jakým jsou tyto oktaedry uspořádány v prostoru, odhaluje strukturu oxidu.
Ovlivňují však také to, jak jsou propojeny. Například dva oktaedry lze spojit dotykem dvou jejich vrcholů, které představují kyslíkový můstek: Fe-O-Fe. Podobně se oktaedrony mohou spojit svými hranami (vedle sebe). To by pak bylo reprezentováno dvěma kyslíkovými můstky: Fe- (O)dva-Víra.
A konečně, oktaedry mohou interagovat prostřednictvím jejich tváří. Reprezentace by tedy nyní byla se třemi kyslíkovými můstky: Fe- (O)3-Fe. Způsob, jakým jsou oktaedry spojeny, by měnil mezijaderné vzdálenosti Fe-Fe, a tedy i fyzikální vlastnosti oxidu.
Vlastnosti
Oxid železa je sloučenina s magnetickými vlastnostmi. Mohou být anti, ferro nebo ferimagnetické a závisí na valencích Fe a na tom, jak kationy interagují v pevné látce..
Protože struktury pevných látek jsou velmi rozmanité, mění se i jejich fyzikální a chemické vlastnosti.
Například polymorfy a hydráty FedvaNEBO3 mají různé hodnoty bodů tání (které se pohybují mezi 1200 a 1600 ° C) a hustoty. Společně však mají nízkou rozpustnost v důsledku Fe3+, stejné molekulové hmotnosti, jsou hnědé barvy a rozpouští se mírně v kyselých roztocích.
Nomenklatura
IUPAC zavádí tři způsoby, jak pojmenovat oxid železa. Všechny tři jsou velmi užitečné, i když pro komplexní oxidy (například Fe7NEBO9) systematická pravidla nad ostatními svou jednoduchostí.
Systematická nomenklatura
Berou se v úvahu počty kyslíku a železa, které jsou pojmenovány řeckými předponami číslování mono-, di-, tri- atd. Podle této nomenklatury je FedvaNEBO3 se jmenuje: trioxid z dalžehlička. A pro Víru7NEBO9 jeho název by byl: non-hepta-oxid železa.
Skladová nomenklatura
To bere v úvahu valenci železa. Pokud jde o Faithdva+, oxid železitý je psán ... a jeho valence s římskými číslicemi v závorkách. Pro vírudvaNEBO3 jmenuje se: oxid železitý.
Všimněte si, že Fe3+ lze určit algebraickými součty. Pokud je Odva- Má dva záporné náboje a jsou tři, přidávají až -6. K neutralizaci této hodnoty -6 je požadováno +6, ale existují dvě Fe, takže musí být vydělena dvěma, + 6/2 = +3:
2X (kovová valence) + 3 (-2) = 0
Pouhým řešením pro X se získá valence Fe v oxidu. Pokud ale X není celé číslo (jako je tomu u téměř všech zbývajících oxidů), pak existuje směs Fedva+ a víra3+.
Tradiční nomenklatura
Přípona -ico je dána předponou ferr-, když Fe má valenci +3, a -oso, když je její valence 2+. FedvaNEBO3 jmenuje se: oxid železitý.
Aplikace
Nanočástice
Oxidy železa mají společnou vysokou krystalizační energii, což umožňuje vytvářet velmi malé krystaly, ale s velkou povrchovou plochou..
Z tohoto důvodu mají velký zájem v oblastech nanotechnologií, kde navrhují a syntetizují oxidové nanočástice (NP) pro specifické účely:
-Jako katalyzátory.
-Jako zásobárna léků nebo genů v těle
-Při navrhování senzorických povrchů pro různé typy biomolekul: bílkoviny, cukry, tuky
-Pro ukládání magnetických dat
Pigmenty
Protože některé oxidy jsou velmi stabilní, lze je použít k barvení textilií nebo k dosažení jasných barev povrchů jakéhokoli materiálu. Z mozaik na podlahách; červené, žluté a oranžové (i zelené) barvy; keramika, plasty, kůže a dokonce i architektonická díla.
Reference
- Správci Dartmouth College. (18. března 2004). Stechiometrie oxidů železa. Převzato z: dartmouth.edu
- Ryosuke Sinmyo a kol. (2016, 8. září). Objev Fe7NEBO9: nový oxid železa se složitou monoklinickou strukturou. Obnoveno z: nature.com
- M. Cornell, U. Schwertmann. Oxidy železa: struktura, vlastnosti, reakce, výskyty a použití. [PDF]. WILEY-VCH. Převzato z: epsc511.wustl.edu
- Alice Bu. (2018). Nanočástice oxidu železitého, vlastnosti a aplikace. Převzato z: sigmaaldrich.com
- Ali, A., Zafar, H., Zia, M., ul Haq, I., Phull, A. R., Ali, J. S., & Hussain, A. (2016). Syntéza, charakterizace, aplikace a výzvy nanočástic oxidu železa. Nanotechnologie, Science and Applications, 9, 49-67. http://doi.org/10.2147/NSA.S99986
- Golchha pigmenty. (2009). Oxidy železa: Aplikace. Převzato z: golchhapigments.com
- Chemická formulace. (2018). Oxid železitý. Převzato z: formulacionquimica.com
- Wikipedia. (2018). Oxid železitý. Převzato z: https://en.wikipedia.org/wiki/Iron(III)_oxide

Zatím žádné komentáře