
Struktura butina, vlastnosti a použití

The butino je chemická sloučenina, která patří do skupiny alkynů, charakterizovaná hlavně tím, že má ve své struktuře alespoň jednu trojnou vazbu mezi dvěma atomy uhlíku.
Pokud jde o stanovení pravidel pro pojmenování alkynů, IUPAC (Mezinárodní unie pro čistou a aplikovanou chemii) stanovila, že se používají stejná pravidla jako pro alkeny..

Základní rozdíl mezi nomenklaturou obou typů látek spočívá v tom, že přípona -eno se změní na -ino, pokud jde o sloučeniny, které mají ve své struktuře trojné vazby..
Na druhé straně je butyn tvořen pouze uhlíkem a vodíkem a vyskytuje se ve dvou formách: 1-butin, který je v plynné fázi za standardních tlakových a teplotních podmínek (1 atm, 25 ° C); a 2-butin, což je druh v kapalné fázi vyráběný chemickou syntézou.
Rejstřík článků
- 1 Chemická struktura
- 1,1 1-butyn
- 1,2 2-butyn
- 2 Vlastnosti
- 3 použití
- 4 Odkazy
Chemická struktura
V molekule známé jako butyn dochází k fenoménu izomerismu strukturní polohy, který spočívá v přítomnosti stejných funkčních skupin v obou sloučeninách, ale každá z nich se nachází v řetězci na jiném místě..
V tomto případě mají obě formy butynu stejný molekulární vzorec; v 1-butynu se však trojná vazba nachází na uhlíku číslo jedna, zatímco v 2-butynu se nachází na čísle dva. Tím se převedou na poziční izomery.
Vzhledem k umístění trojné vazby v jednom z terminálů 1-butinové struktury je považován za terminální alkiny, zatímco střední poloha trojné vazby ve 2-butinové struktuře mu dává klasifikaci interního alkinu.
Vazba tedy může být pouze mezi prvním a druhým uhlíkem (1-butin) nebo mezi druhým a třetím uhlíkem (2-butin). To je způsobeno použitou nomenklaturou, kde se poloze trojné vazby vždy poskytne nejnižší možné číslování..
1-butyn
Sloučenina zvaná 1-butin je také známá jako ethylacetylen, a to díky své struktuře a způsobu uspořádání a vazby čtyř atomů uhlíku. Když však mluvíme o butino odkazuje se pouze na tento chemický druh.
V této molekule je trojná vazba na koncovém uhlíku, což umožňuje dostupnost atomů vodíku, které jí dodávají velkou reaktivitu.
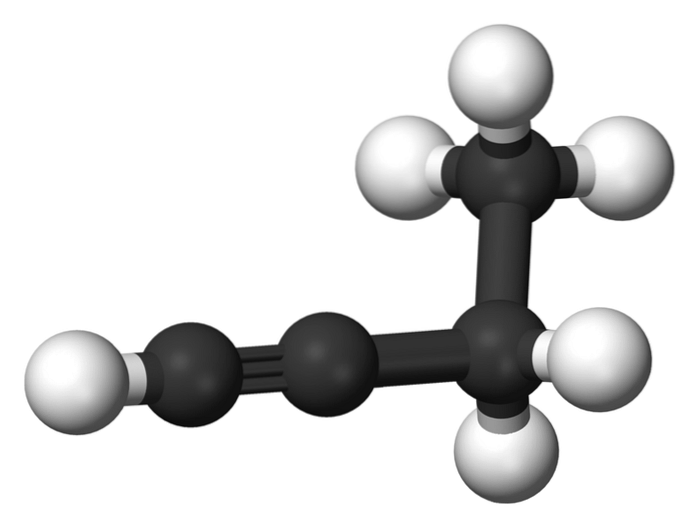
Tato tuhá a silnější vazba než jednoduchá nebo dvojná vazba mezi atomy uhlíku poskytuje stabilní konfiguraci lineární geometrie k 1-butynu..
Na druhé straně je tato plynná látka poměrně hořlavá, takže za tepla může snadno způsobit požár nebo výbuch a za přítomnosti vzduchu nebo vody má vysokou reaktivitu..
2-butyn
Protože vnitřní alkyny vykazují větší stabilitu než koncové alkyny, umožňují transformaci 1-butynu na 2-butin.
K této izomerizaci může dojít zahříváním 1-butynu v přítomnosti báze (jako je NaOH, KOH, NaOCH3 ...) nebo přesmykem 1-butynu v roztoku hydroxidu draselného (KOH) v ethanolu (CdvaH6NEBO).
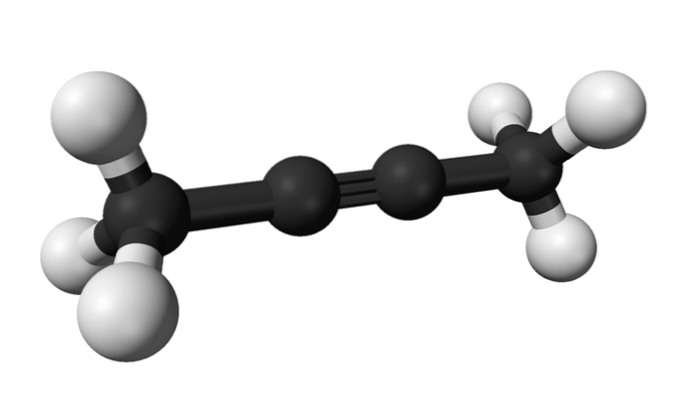
Stejným způsobem se chemická látka známá jako 2-butyn také nazývá dimethylacetylen (nebo krotonylen) a představuje se jako kapalná a těkavá látka, která pochází uměle..
V 2-butynu se trojná vazba nachází uprostřed molekuly, což jí dává větší stabilitu než její izomer.
Kromě toho má tato bezbarvá sloučenina nižší hustotu než voda, i když je v ní považována za nerozpustnou a má vysokou hořlavost..
Vlastnosti
-Strukturní vzorec butynu (bez ohledu na to, na který izomer se odkazuje) je C4H6, který má lineární strukturu.
-Jednou z chemických reakcí, které molekula butynu prochází, je izomerizace, při které v molekule dochází k přeskupení a migraci trojné vazby..
-1-butin je v plynné fázi, má velmi vysokou hořlavost a vyšší hustotu než vzduch.
-Tato látka je také docela reaktivní a za přítomnosti tepla může způsobit prudké výbuchy..
-Kromě toho, pokud tento bezbarvý plyn prochází neúplnou spalovací reakcí, může způsobit oxid uhelnatý (CO).
-Když jsou oba izomery vystaveny vysokým teplotám, mohou podstoupit výbušné polymerační reakce..
-2-Butyne je v kapalné fázi, i když je také považován za docela hořlavý za standardních podmínek tlaku a teploty..
-Pokud jsou tyto látky v přítomnosti silně oxidujících látek, mohou podstoupit prudké reakce..
-Stejným způsobem, když jsou v přítomnosti redukujících druhů, dochází k exotermickým reakcím s následným uvolňováním plynného vodíku..
-Při kontaktu s určitými katalyzátory (například některými kyselými látkami) nebo iniciačními druhy může dojít k exotermickým polymeračním reakcím.
Aplikace
Protože mají některé odlišné vlastnosti, oba izomery mohou mít různá použití a aplikace, jak je uvedeno níže:
Na prvním místě je velmi často jednou z aplikací 1-butynu jeho použití jako mezistupně ve výrobním procesu jiných látek organické povahy syntetického původu..
Na druhou stranu se tato chemická látka používá v průmyslu výroby gumy a odvozených sloučenin; například když chcete získat benzol.
Podobným způsobem se používá při výrobě nejrůznějších plastových výrobků i při výrobě mnoha polyethylenových látek považovaných za látky s vysokou hustotou..
1-butin se také často používá jako součást pro procesy řezání a svařování některých kovových slitin, včetně oceli (slitina železo-uhlík)..
V jiném smyslu se 2-butinový isomer používá v kombinaci s jiným alkynem nazývaným propin při syntéze některých látek známých jako alkylované hydrochinony, když se provádí celkový proces syntézy a-tokoferolu (vitaminu E)..
Reference
- Wikipedia. (s.f.). Butyne. Obnoveno z en.wikipedia.org
- Yoder, C. H., Leber P. A. a Thomsen, M. W. (2010). Most k organické chemii: koncepty a názvosloví. Obnoveno z books.google.co.ve
- Study.com. (s.f.). Butyne: Strukturní vzorec a izomery. Získáno ze studie.
- PubChem. (s.f.). 1-Butyne. Obnoveno z pubchem.ncbi.nlm.nih.gov
- PubChem. (s.f.). 2-Butyne. Citováno z pubchem.ncbi.nlm.nih.gov

Zatím žádné komentáře