
Změny typů stavů a jejich charakteristik (s příklady)

The změny stavu nebo fáze jsou termodynamický jev, kdy hmota prochází reverzibilními fyzickými změnami. Říká se, že je termodynamická, protože dochází k přenosu tepla mezi hmotou a okolím; nebo co je stejné, existují interakce mezi hmotou a energií, které vyvolávají přeskupení částic.
Částice, které procházejí změnou stavu, zůstávají stejné před změnou i po ní. Tlak a teplota jsou důležitými proměnnými v tom, jak jsou ubytovány v jedné nebo druhé fázi. Když dojde ke změně stavu, vytvoří se dvoufázový systém složený ze stejné hmoty ve dvou různých fyzikálních stavech.
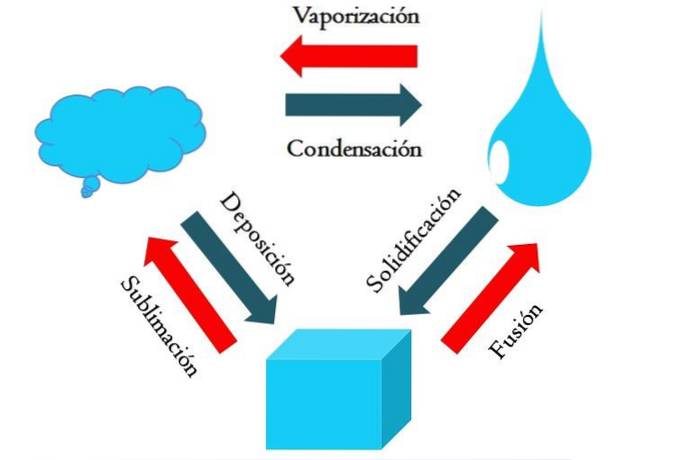
Obrázek výše ukazuje hlavní změny stavu, kterým hmota za normálních podmínek prochází..
Pevná kostka modravé látky se může stát kapalnou nebo plynnou v závislosti na teplotě a tlaku svého okolí. Samo o sobě představuje jednu fázi: pevnou látku. Ale v okamžiku tání, tedy tání, nastává rovnováha pevné látky a kapaliny zvaná fúze (červená šipka mezi modravou krychlí a poklesem).
Aby došlo k fúzi, musí kostka absorbovat teplo ze svého okolí, aby zvýšila svoji teplotu; proto se jedná o endotermický proces. Jakmile je kostka úplně roztavena, vrací se do jedné fáze: do kapalného stavu.
Tato modravá kapka může i nadále absorbovat teplo, což zvyšuje jeho teplotu a vede k tvorbě plynných bublin. Opět existují dvě fáze: jedna kapalina a druhá plyn. Když se veškerá kapalina odpaří prostřednictvím bodu varu, říká se, že se vařila nebo odpařila..
Nyní se modravé kapky změnily v mraky. Doposud byly všechny procesy endotermické. Modrý plyn může pokračovat v absorpci tepla, dokud se nezahřeje; Avšak vzhledem k pozemským podmínkám má sklon ochladit se a kondenzovat zpět do kapaliny (kondenzace)..
Na druhou stranu mohou být mraky také ukládány přímo na pevnou fázi, čímž se znovu vytvoří pevná kostka (depozice). Tyto poslední dva procesy jsou exotermické (modré šipky); to znamená, že uvolňují teplo do prostředí nebo do okolí.
Kromě kondenzace a depozice dochází ke změně stavu, když modravá kapka zmrzne při nízkých teplotách (tuhnutí).
Rejstřík článků
- 1 Typy změn stavu a jejich charakteristika
- 1.1 - Fúze
- 1.2 - Odpařování
- 1.3 - Kondenzace
- 1.4 - Tuhnutí
- 1.5 - Sublimace
- 1.6 - Depozice
- 2 Další změny stavu
- 3 Odkazy
Druhy změn stavu a jejich charakteristika
Obrázek ukazuje typické změny pro tři (nejběžnější) stavy hmoty: pevný, kapalný a plynný. Změny doprovázené červenými šipkami jsou endotermické a zahrnují absorpci tepla; zatímco ti, kteří jsou doprovázeni modrými šipkami, jsou exotermní, uvolňují teplo.
Níže bude uveden stručný popis každé z těchto změn, který zvýrazní některé z jejich charakteristik z molekulárního a termodynamického uvažování..
- Fúze
Fúze je změna skupenství látky z pevné na kapalnou..
V pevném stavu jsou částice (ionty, molekuly, shluky atd.) „Vězni“, kteří se nacházejí v pevných pozicích v prostoru, aniž by se mohli volně pohybovat. Jsou však schopné vibrovat na různých frekvencích, a pokud jsou velmi silné, přísný řád uložený mezimolekulárními silami se začne „rozpadat“..
Ve výsledku se získají dvě fáze: jedna, kde částice zůstávají uzavřené (pevné), a druhá, kde jsou volnější (kapalné), což stačí ke zvětšení vzdáleností, které je oddělují. K dosažení tohoto cíle musí pevná látka absorbovat teplo, a tak její částice budou vibrovat větší silou..
Z tohoto důvodu je fúze endotermická, a když začíná, říká se, že mezi fázemi pevná látka-kapalina nastává rovnováha..
Teplo nezbytné k vyvolání této změny se nazývá teplo nebo molární entalpie fúze (ΔHFus). To vyjadřuje množství tepla (energie, hlavně v jednotkách kJ), které musí mol látky v pevném stavu absorbovat, aby se roztavil, a nikoli jednoduše zvýšit jeho teplotu.
Sněhová koule

S ohledem na to je zřejmé, proč se sněhová koule taví v ruce (horní obrázek). Sníh absorbuje tělesné teplo, což je dostatečné pro zvýšení teploty sněhu nad 0 ° C.
Ledové krystaly ve sněhu absorbují jen tolik tepla, aby se roztavily a aby jejich molekuly vody získaly chaotičtější strukturu. Zatímco se sníh topí, vytvořená voda nezvýší svoji teplotu, protože veškeré teplo z ruky využívá sníh k dokončení jeho tání.
- Vypařování

Odpařování je změna skupenství látky z kapalného do plynného skupenství.
Pokračováním příkladu vody, kdy nyní hrst sněhu umístíte do hrnce a zapálíte oheň, je pozorováno, že sníh rychle taje. Jak se voda ohřívá, uvnitř se začnou tvořit malé bublinky oxidu uhličitého a dalších možných plynných nečistot..

Teplo molekulárně rozšiřuje neuspořádané konfigurace vody, rozšiřuje její objem a zvyšuje její tlak par; proto existuje několik molekul, které unikají z povrchu v důsledku rostoucího odpařování.
Kapalná voda pomalu zvyšuje teplotu díky vysokému měrnému teplu (4,184 J / ° C ∙ g). Nastává bod, kdy teplo, které absorbuje, se již nepoužívá ke zvýšení jeho teploty, ale k nastolení rovnováhy kapalina-pára; to znamená, že začne vřít a veškerá kapalina přejde do plynného stavu, přičemž absorbuje teplo a udržuje konstantní teplotu.
Zde vidíte intenzivní bublání na povrchu převařené vody (horní obrázek). Teplo absorbované kapalnou vodou tak, aby se tlak par jejích začínajících bublin rovnal vnějšímu tlaku, se nazývá entalpie odpařování (ΔHPára).
Role tlaku
Tlak je rozhodující také při změnách stavu. Jaký je jeho účinek na vaporizaci? Čím vyšší je tlak, tím větší je teplo, které musí voda absorbovat k varu, a proto se odpařuje nad 100 ° C.
Je to proto, že zvýšení tlaku ztěžuje molekulám vody únik z kapaliny do plynné fáze..
Tlakové hrnce tuto skutečnost využívají ve svůj prospěch k ohřívání jídla ve vodě na teplotu vyšší než je jeho teplota varu..
Na druhou stranu, protože dochází k vakuu nebo ke snížení tlaku, potřebuje kapalná voda nižší teplotu, aby se vařila a přecházela do plynné fáze. Při velkém nebo malém tlaku, když voda vře, musí absorbovat příslušné výparné teplo, aby dokončila svou změnu stavu..
- Kondenzace
Kondenzace je změna skupenství látky z plynného do kapalného skupenství.

Voda se odpařila. Co bude dál? Vodní pára může stále zvyšovat svoji teplotu a stát se nebezpečným proudem, který může způsobit vážné popáleniny..
Předpokládejme však, že místo toho ochlazuje. Jak? Uvolňování tepla do životního prostředí a uvolňování tepla je považováno za exotermní proces, který probíhá.
Uvolňováním tepla se velmi energetické molekuly plynné vody začínají zpomalovat. Rovněž jejich interakce se stávají účinnějšími, když teplota páry klesá. Nejprve se vytvoří vodní kapičky, kondenzované z páry, následované většími kapičkami, které nakonec přitáhne gravitace.
Chcete-li plně kondenzovat dané množství páry, musíte uvolnit stejnou energii, ale s opačným znaménkem, při ΔHPára; tj. jeho entalpie kondenzace ΔHKond. Tím je zajištěna inverzní rovnováha pára-kapalina.
Vlhká okna

Na samotných oknech domů je vidět kondenzace. V chladném podnebí se vodní pára obsažená uvnitř domu sráží s oknem, které má díky svému materiálu nižší teplotu než jiné povrchy..
Tam se snáze shlukují molekuly páry a vytvářejí tenkou bělavou vrstvu snadno odnímatelnou ručně. Vzhledem k tomu, že tyto molekuly uvolňují teplo (zahřívání skla a vzduchu), začínají vytvářet více shluků, dokud první kapky nemohou kondenzovat (horní obrázek).
Když jsou kapky velmi velké, sklouznou z okna a zanechají stopu vody.
- Tuhnutí
Tuhnutí je změna skupenství látky z kapalného do tuhého stavu.

K tuhnutí dochází v důsledku chlazení; jinými slovy, voda zmrzne. Aby voda zmrzla, musí uvolňovat stejné množství tepla, které absorbuje led, aby se roztavilo. Toto teplo se opět nazývá entalpie tuhnutí nebo zmrazení, ΔHCong (-ΔHFus).
Jak se molekuly vody ochladí, ztrácejí energii a jejich mezimolekulární interakce jsou silnější a směrovější. Ve výsledku jsou uspořádány díky svým vodíkovým vazbám a tvoří takzvané ledové krystaly. Mechanismus růstu ledových krystalů má vliv na jejich vzhled: průhledný nebo bílý.

Pokud ledové krystaly rostou velmi pomalu, nezakrývají nečistoty, jako jsou plyny, které se rozpouštějí ve vodě za nízkých teplot. Bubliny tedy unikají a nemohou interagovat se světlem; a následně máte led tak průhledný jako led mimořádné ledové sochy (horní obrázek).
Totéž se děje s ledem, může se to stát s jakoukoli jinou látkou, která ochlazením tuhne. Možná jde o nejsložitější fyzickou změnu v pozemských podmínkách, protože lze získat několik polymorfů.
- Sublimace
Sublimace je změna skupenství látky z pevného do plynného skupenství.
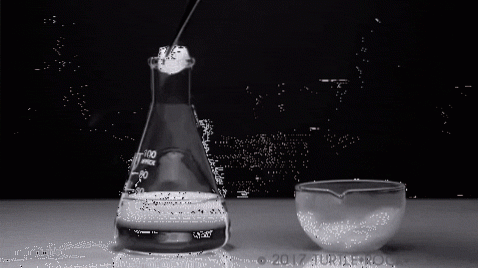
Může být voda sublimována? Ne, alespoň ne za normálních podmínek (T = 25 ° C, P = 1 atm). Aby došlo k sublimaci, tj. Ke změně stavu z pevné látky na plyn, musí být tlak par pevné látky vysoký.
Stejně tak je nezbytné, aby jejich mezimolekulární síly nebyly příliš silné, nejlépe pokud se skládají pouze z disperzních sil.
Nejvýraznějším příkladem je pevný jód. Je to krystalická pevná látka se šedavě fialovými odstíny, která představuje vysoký tlak par. A to natolik, že při jeho působení se vydává fialová pára, jejíž objem a expanze jsou patrné při zahřátí.

Na výše uvedeném obrázku je znázorněn typický experiment, při kterém se pevný jod odpařuje ve skleněné nádobě. Je zajímavé a nápadné sledovat, jak jsou fialové páry rozptýleny, a zasvěcený student si může ověřit nepřítomnost kapalného jódu.
Toto je hlavní charakteristika sublimace: není přítomna kapalná fáze. Podobně je endotermní, protože pevná látka absorbuje teplo, aby zvýšila svůj tlak par, dokud se nerovná vnějšímu tlaku..
- Depozice

Depozice je změna skupenství látky z plynného skupenství do pevného skupenství.
Souběžně s jódovým sublimačním experimentem existuje i jeho depozice. Depozice je opačná změna nebo přechod: látka přechází z plynného stavu do pevné látky bez tvorby kapalné fáze.
Když fialové jódové páry přijdou do kontaktu se studeným povrchem, uvolní teplo, aby ho zahřály, ztratily energii a přeskupily své molekuly zpět do šedavě fialové pevné látky (horní obrázek). Jedná se pak o exotermický proces.
Depozice je široce používána pro syntézu materiálů, kde jsou dotovány atomy kovů sofistikovanými technikami. Je-li povrch velmi studený, je tepelná výměna mezi ním a parními částicemi prudká a odpadá průchod příslušnou kapalnou fází..
Teplo nebo entalpie depozice (a ne vklad) je inverzní sublimace (ΔHSub= - ΔHD.E.P.). Teoreticky lze mnoho látek sublimovat, ale k dosažení tohoto cíle je kromě manipulace s jejich P vs T diagramem nutné manipulovat s tlaky a teplotami; ve kterém lze vizualizovat jeho vzdálené možné fáze.
Další změny stavu
Ačkoli o nich není zmínka, existují i jiné stavy hmoty. Někdy se vyznačují tím, že mají „trochu od každého“, a proto jsou jejich kombinací. Aby bylo možné je generovat, musí být tlaky a teploty upraveny na velmi kladné (velké) nebo záporné (malé) velikosti..
Například pokud se plyny nadměrně zahřívají, ztratí své elektrony a jejich pozitivně nabitá jádra v tomto negativním přílivu vytvoří to, co je známé jako plazma. Je synonymem pro „elektrický plyn“, protože má vysokou elektrickou vodivost.
Na druhou stranu, když teploty klesnou příliš nízko, může se hmota chovat neočekávaným způsobem; to znamená, že vykazují jedinečné vlastnosti kolem absolutní nuly (0 K).
Jednou z těchto vlastností je supratekutost a supravodivost; stejně jako tvorba Bose-Einsteinových kondenzátů, kde se všechny atomy chovají jako jeden celek.
Některé výzkumy dokonce poukazují na fotonickou hmotu. V nich se částice elektromagnetického záření, fotony, seskupují a vytvářejí fotonické molekuly. To znamená, že by to teoreticky dalo hmotu tělům světla.
Reference
- Helmenstine, Anne Marie, Ph.D. (19. listopadu 2018). Seznam fázových změn mezi stavy hmoty. Obnoveno z: thoughtco.com
- Wikipedia. (2019). Stav hmoty. Obnoveno z: en.wikipedia.org
- Dorling Kindersley. (2007). Měnící se státy. Obnoveno z: factmonster.com
- Meyers Ami. (2019). Fázová změna: odpařování, kondenzace, zmrazování, tavení, sublimace a depozice. Studie. Obnoveno z: study.com
- Bagley M. (11. dubna 2016). Hmota: Definice a pět stavů hmoty. Obnoveno z: livescience.com
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.

Zatím žádné komentáře