
Charakteristiky kapilarity a příklad ve vodě
The kapilarita Jedná se o vlastnost kapalin, která jim umožňuje pohybovat se trubkovými otvory nebo porézními povrchy i proti gravitační síle. K tomu musí existovat rovnováha a koordinace dvou sil souvisejících s molekulami kapaliny: soudržnost a adheze; tito dva mají fyzický odraz zvaný povrchové napětí.
Kapalina musí být schopna navlhčit vnitřní stěny trubice nebo póry materiálu, kterým prochází. K tomu dochází, když je adhezní síla (stěna kapalné kapiláry) větší než intermolekulární kohezní síla. V důsledku toho molekuly kapaliny vytvářejí silnější interakce s atomy materiálu (sklo, papír atd.) Než navzájem..
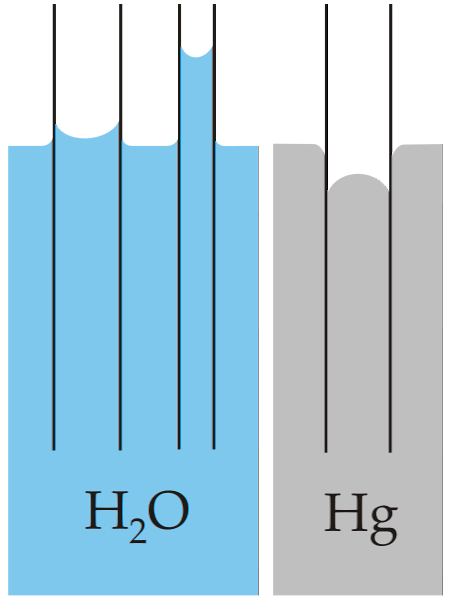
Klasický příklad kapilarity je ilustrován porovnáním této vlastnosti pro dvě velmi odlišné kapaliny: vodu a rtuť..
Na obrázku výše je vidět, že voda stoupá po stěnách trubice, což znamená, že má větší adhezní síly; zatímco u rtuti nastává opak, protože jeho kohezní síly kovové vazby brání smáčení skla.
Z tohoto důvodu voda tvoří konkávní meniskus a rtuť konvexní (kopulovitý) meniskus. Je také třeba poznamenat, že čím menší je poloměr trubice nebo průřez kapaliny, tím větší je výška nebo vzdálenost (porovnejte výšky vodních sloupců pro obě trubice).
Rejstřík článků
- 1 Charakteristika kapilarity
- 1.1 - Povrch kapaliny
- 1,2 - výška
- 1.3 - Povrchové napětí
- 1,4 - Poloměr kapiláry nebo póru, kterým kapalina stoupá
- 1,5 - Úhel kontaktu (θ)
- 2 Kapilarita vody
- 2.1 V rostlinách
- 3 Odkazy
Charakteristiky kapilarity
-Tekutý povrch
Povrch kapaliny, řekněme vody, v kapiláře je konkávní; to znamená, že meniskus je konkávní. K této situaci dochází, protože výslednice sil působících na molekuly vody poblíž stěny trubice je směrována k tomuto.
V každém menisku je kontaktní úhel (θ), což je úhel tvořený stěnou kapilární trubice s přímkou tečnou k povrchu kapaliny v místě kontaktu.
Adhezní a kohezní síly
Pokud adhezní síla kapaliny ke stěně kapiláry převládá nad intermolekulární kohezní silou, pak úhel je θ < 90º; el líquido moja la pared capilar y el agua asciende por el capilar, observándose el fenómeno conocido como capilaridad.
Když je kapka vody umístěna na povrch čistého skla, voda se rozšíří přes sklo, takže θ = 0 a cos θ = 1.
Pokud převládá mezimolekulární kohezní síla nad adhezní silou ke stěně kapaliny a kapiláry, například ve rtuti, bude meniskus konvexní a úhel θ bude mít hodnotu> 90 °; rtuť nenavlhčí stěnu kapiláry, a proto stéká po její vnitřní stěně.
Když je kapka rtuti umístěna na povrch čistého skla, kapka si udrží svůj tvar a úhel θ = 140 °.
-Výška
Voda stoupá kapilárou až do výšky (h), ve které váha vodního sloupce kompenzuje vertikální složku mezimolekulární kohezní síly.
Jak více vody stoupá, přijde bod, kdy gravitace zastaví svůj výstup, a to i při povrchovém napětí ve váš prospěch..
Když k tomu dojde, molekuly nemohou dále „šplhat“ po vnitřních stěnách a všechny fyzické síly se vyrovnají. Na jedné straně jsou síly, které podporují vzestup vody, a na druhé straně její vlastní váha, která ji tlačí dolů.
Jurinův zákon
Toto lze matematicky napsat následovně:
2 π rϒcosθ = ρgπrdvah
Kde levá strana rovnice závisí na povrchovém napětí, jehož velikost také souvisí s kohezními nebo mezimolekulárními silami; Cosθ představuje kontaktní úhel a r poloměr otvoru, kterým kapalina stoupá.
A na pravé straně rovnice máme výšku h, gravitační sílu g a hustotu kapaliny; co by byla voda.
Řešení tedy pro h máme
h = (2ϒcosθ / ρgr)
Tato formulace je známá jako Jurinův zákon, který definuje výšku dosaženou sloupcem kapaliny v kapilární trubici, když je hmotnost sloupce kapaliny vyvážena silou vzestupu kapilárním působením..
-Povrchové napětí
Voda je molekula dipólu, kvůli elektronegativitě atomu kyslíku a jeho molekulární geometrii. To způsobí, že část molekuly vody, kde se nachází kyslík, se stane záporně nabitou, zatímco část molekuly vody, která obsahuje 2 atomy vodíku, je nabitá kladně..
Molekuly v kapalině díky tomu interagují prostřednictvím více vodíkových vazeb a drží je pohromadě. Molekuly vody, které jsou v rozhraní voda: vzduch (povrch), jsou však vystaveny síťové přitažlivosti molekulami sinusu kapaliny, což není kompenzováno slabou přitažlivostí s molekulami vzduchu.
Proto jsou molekuly vody na rozhraní vystaveny přitažlivé síle, která má tendenci odstraňovat molekuly vody z rozhraní; to znamená, že vodíkové vazby vytvořené s molekulami dole táhnou ty, které jsou na povrchu. Povrchové napětí se tedy snaží zmenšit povrch rozhraní voda: vzduch..
Vztah s h
Podíváme-li se na Jurinovu rovnici zákona, zjistíme, že h je přímo úměrné ϒ; proto čím vyšší je povrchové napětí kapaliny, tím větší je výška, která může stoupat kapilárou nebo póry materiálu.
Tímto způsobem lze očekávat, že u dvou kapalin, A a B, s různým povrchovým napětím, bude ta s vyšším povrchovým napětím stoupat do vyšší výšky..
S ohledem na tento bod lze vyvodit závěr, že vysoké povrchové napětí je nejdůležitější charakteristikou, která definuje kapilární vlastnost kapaliny..
-Poloměr kapiláry nebo póru, kterým kapalina stoupá
Pozorování Jurinova zákona naznačuje, že výška, kterou kapalina dosáhne v kapiláře nebo póru, je nepřímo úměrná poloměru stejné.
Čím menší je poloměr, tím větší je výška, kterou sloupec kapaliny dosahuje kapilaritou. To lze vidět přímo na snímku, kde se voda porovnává se rtutí.
Ve skleněné trubici s poloměrem o poloměru 0,05 mm dosáhne sloupec vody na kapilaritu výšky 30 cm. V kapilárách o poloměru 1 µm se sacím tlakem 1,5 x 103 hPa (což se rovná 1,5 atm) odpovídá výpočtu výšky vodního sloupce od 14 do 15 m.
Je to velmi podobné tomu, co se stane s těmi brčky, které se několikrát zapnou. Usrkáním kapaliny se vytvoří tlakový rozdíl, který způsobí, že kapalina stoupne do úst.
Maximální výška sloupce dosažená kapilaritou je teoretická, protože poloměr kapilár nelze za určitou hranicí zmenšit..
Poiseuilleův zákon
Tím se stanoví, že tok skutečné kapaliny je dán následujícím výrazem:
Q = (πr4/ 8ηl) ΔP
Kde Q je tok kapaliny, η je jeho viskozita, l je délka trubky a ΔP je tlakový rozdíl.
Jak se zmenšuje poloměr kapiláry, měla by se výška sloupce kapaliny dosažená kapilárním působením zvyšovat neomezeně. Poiseuille však poukazuje na to, že se zmenšujícím se poloměrem klesá také průtok kapaliny touto kapilárou..
Viskozita, která je měřítkem odporu proti proudění skutečné kapaliny, by dále snižovala průtok kapaliny..
-Kontaktní úhel (θ)
Čím větší je hodnota cosθ, tím větší je výška vodního sloupce kapilaritou, jak naznačuje Jurinův zákon.
Pokud je θ malé a blíží se nule (0), cosθ je = 1, takže hodnota h bude maximální. Naopak, pokud se θ rovná 90 °, cosθ = 0 a hodnota h = 0.
Je-li hodnota θ větší než 90 °, což je případ konvexního menisku, kapalina nezvyšuje kapilaritou a má tendenci klesat (jak je tomu u rtuti).
Kapilarita vody
Voda má hodnotu povrchového napětí 72,75 N / m, relativně vysokou ve srovnání s hodnotami povrchového napětí následujících kapalin:
-Aceton: 22,75 N / m
-Ethylalkohol: 22,75 N / m
-Hexan: 18,43 N / m
-Metanol: 22,61 N / m.
Voda má proto výjimečné povrchové napětí, které podporuje rozvoj kapilaritního jevu nezbytného pro absorpci vody a živin rostlinami..
V rostlinách

Kapilarita je důležitým mechanismem pro výstup mízy přes xylem rostlin, ale sama o sobě je nedostatečná k tomu, aby se míza dostala k listím stromů..
Potění nebo odpařování je důležitým mechanismem při výstupu mízy přes xylem rostlin. Listy ztrácí vodu odpařováním, což vede ke snížení množství molekul vody, což způsobuje přitahování molekul vody přítomných v kapilárách (xylem).
Molekuly vody nepůsobí nezávisle na sobě, ale interagují s Van der Waalsovými silami, což způsobuje jejich vzestup propojený kapilárami rostlin směrem k listům.
Kromě těchto mechanismů je třeba poznamenat, že rostliny absorbují vodu z půdy osmózou a že pozitivní tlak vytvářený v kořenu řídí začátek vzestupu vody kapilárními trubkami rostliny..
Reference
- García Franco A. (2010). Povrchní jevy. Obnoveno z: sc.ehu.es
- Povrchové jevy: povrchové napětí a kapilarita. [PDF]. Obnoveno z: ugr.es
- Wikipedia. (2018). Kapilarita. Obnoveno z: es.wikipedia.org
- Risvhan T. (s.f.) Kapilarita v rostlinách. Obnoveno z: academia.edu
- Helmenstine, Anne Marie, Ph.D. (22. prosince 2018). Kapilární akce: Definice a příklady. Obnoveno z: thoughtco.com
- Ellen Ellis M. (2018). Kapilární působení vody: Definice a příklady. Studie. Obnoveno z: study.com
- Zaměstnanci ScienceStruck. (16. července 2017). Příklady, které vysvětlují koncept a význam kapilárního působení. Obnoveno z: sciencestruck.com



Zatím žádné komentáře