
Struktura, vlastnosti, použití uhličitanu lithného (Li2CO3)

The uhličitan lithný je anorganická pevná látka tvořená dvěma lithiovými kationty Li+ a uhličitanový anion CO3dva-. Jeho chemický vzorec je LidvaCO3. LidvaCO3 je bílá krystalická pevná látka, kterou lze získat reakcí mezi hydroxidem lithným a oxidem uhličitým.
Uhličitan lithný má velmi vysokou teplotu tání, a proto se používá při přípravě sklenic, keramiky a porcelánu. Má širokou škálu použití, například v dobíjecích lithiových bateriích, při přípravě dalších sloučenin lithia, ve svařovacích elektrodách a ve barvách a lacích..

Li se také používádvaCO3 v cementových směsích pro rychlé tuhnutí a výrobu hliníku.
Jedno z jeho nejdůležitějších použití je mimo jiné při léčbě některých duševních chorob, jako jsou deprese a nadměrně agresivní chování..
Jeho použití jako léčiva však musí být řádně kontrolováno lékařem, protože lidé léčení LidvaCO3 může mít škodlivé účinky na zdraví, jako je hypotyreóza (snížená funkce štítné žlázy).
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Fyzikální vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Rozklad
- 3.5 Hustota
- 3.6 Rozpustnost
- 3,7 pH
- 4 Chemické vlastnosti
- 5 Biologické vlastnosti
- 6 Získání
- 7 použití
- 7.1 Při léčbě duševních chorob
- 7.2 Při léčbě příznaků jiných nemocí
- 7.3 Způsob podání
- 8 Nežádoucí účinky
- 8.1 Případy, kdy by neměl být podáván
- 9 Jiná použití
- 10 Reference
Struktura
Uhličitan lithný se skládá ze dvou lithiových lithných kationtů+ a uhličitanový anion CO3dva-.
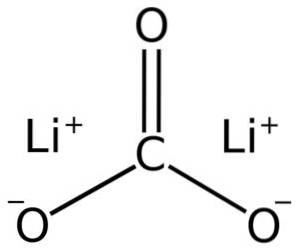
Elektronová konfigurace lithia v oxidačním stavu +1 je 1 sdva 2 s0, protože ztratil elektron poslední skořápky, čímž je stabilnější. Uhličitanový ion CO3dva- má rovnou strukturu.
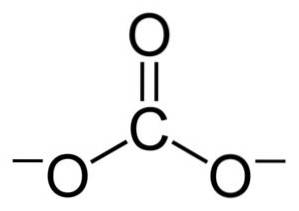
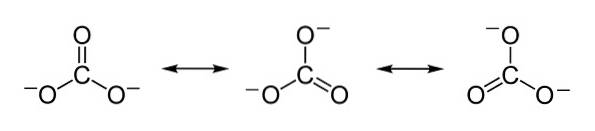
Záporné náboje jsou rovnoměrně rozloženy mezi tři atomy kyslíku uhličitanového iontu CO3dva-.
Nomenklatura
-Uhličitan lithný
-Dilithium uhličitan
Fyzikální vlastnosti
Fyzický stav
Bílá krystalická pevná látka s monoklinickou strukturou
Molekulární váha
73,9 g / mol
Bod tání
723 ° C
Rozklad
Rozkládá se při 1300 ° C.
Hustota
2,11 g / cm3
Rozpustnost
Mírně rozpustný ve vodě: 1,31% hmotnostních při 20 ° C. Jeho rozpustnost ve vodě klesá s rostoucí teplotou. Je rozpustný ve zředěných kyselinách. Je nerozpustný v alkoholu a acetonu.
pH
Roztoky ve vodě jsou zásadité, mají pH vyšší než 7.
Chemické vlastnosti
LidvaCO3 hydrolyzuje ve vodném roztoku za vzniku zásaditého roztoku. Malý podíl sloučeniny, která je solubilizována ve vodě, nechává uhličitanový anion CO volný.3dva-.
Uhličitanový anion CO3dva- volný ve vodném roztoku vezme proton za vzniku hydrogenuhličitanového anionu HCO3-, jak je vidět na následující reakci:
CO3dva- + HdvaO → HCO3- + Ach-
Přítomnost OH iontů- je základem řešení.
Biologické vlastnosti
Stopy iontu lithia jsou normálně přítomny ve zvířecích a lidských tkáních, ale dosud není známa žádná přirozená fyziologická role tohoto iontu..
V lidském organismu LidvaCO3 požití jako lék působí na různé signální mechanismy v neuronech a dalších buňkách. To je výsledkem náhrady kationtů, jako je sodík a draslík.
Začlenění lithiového iontu do struktury buněčné membrány může změnit reakci na hormony a vazbu buňky s energetickými procesy..
Tímto způsobem lithium modifikuje několik buněčných procesů včetně metabolismu..
Úpravou způsobu fungování buněk LidvaCO3 může působit na komunikační mechanismy neuronů v mozku.
Získávání
LidvaCO3 lze získat reakcí hydroxidu lithného LiOH s oxidem uhličitým COdva, Jak je ukázáno níže:
2 LiOH + COdva → LidvaCO3 + HdvaNEBO
Je komerčně vyráběn z minerálů obsahujících lithium, jako je spodumen a lepidolit. Tyto minerály jsou zpracovány při vysokých teplotách určitými sulfátovými solemi nebo alkalickými sloučeninami za účelem získání lithiových solí..
Získané lithné soli se čistí vodou nebo kyselými roztoky a poté se na ně působí uhličitany za vzniku LidvaCO3.
LidvaCO3 Tímto způsobem je kontaminován sírany nebo chloridy vápníku, hořčíku, železa, sodíku, draslíku atd. vyžaduje tedy další čištění.
Aplikace
Při léčbě duševních chorob
Používá se jako antidepresivum, antimanikum, při léčbě agresivně-impulzivního chování a při bipolárních poruchách (lidé, kteří náhle změní příčinu bez jakékoli příčiny, stávají se násilníky).

Lékaři zjistili, že jeho podávání vede ke snížení intenzity a frekvence závažných období deprese a manických epizod..
Používá se samostatně, to znamená bez jakékoli přidané sloučeniny, při udržovací terapii unipolární deprese a při schizoafektivní poruše. Slouží také ke zvýšení antidepresivního účinku jiných léků.
Ačkoli se používá k léčbě dětí se zjevnými příznaky bipolární poruchy a hyperaktivity s neurotickými nebo agresivními složkami, není ve všech případech účinný..
Při léčbě příznaků jiných nemocí
Používá se ke snížení frekvence závažných, opakujících se a chronických bolestí hlavy.
Používá se ke snížení výskytu infekce u pacientů s neutropenií vyvolanou chemoterapií nebo z jiných důvodů. Neutropenie je pokles neutrofilů, což je typ bílých krvinek, který pomáhá bojovat proti infekcím v těle.
Používá se jako inhibitor enzymu štítné žlázy k léčbě hypertyreózy, ale není to preferovaná léčba kvůli jeho nepříznivým účinkům.
Forma podání
Používá se ve formě tablet nebo tobolek LidvaCO3. Také v tabletách s pomalým uvolňováním s citrátem lithným. Li je preferovánodvaCO3 protože při požití nedráždí krk, jako je tomu v případě jiných solí lithia.

Nepříznivé účinky
LidvaCO3 může mít škodlivý účinek na štítnou žlázu a ledviny, proto by měla být sledována funkce těchto orgánů před a během léčby touto sloučeninou..
LidvaCO3 může být toxický při koncentracích velmi blízkých koncentracím používaným při lékařských ošetřeních, proto je nutný nepřetržitý přehled jeho hodnot v krevním séru.
Příznaky otravy LidvaCO3 jsou třes, svalové křeče, svalová slabost, průjem, zvracení, ospalost nebo ataxie (zhoršená svalová koordinace), mimo jiné.
Při zahájení léčby LidvaCO3 Mohou se také objevit příznaky jako třes, bolesti hlavy a nevolnost. Ale tyto mají tendenci mizet, jak léčba pokračuje..
U většiny léčených lidí se může také vyvinout leukocytóza (zvýšení počtu bílých krvinek), ale je to reverzibilní..
Lidé, kteří jsou léčeni LidvaCO3 neměli by řídit vozidla ani obsluhovat stroje, protože fyzická koordinace a schopnost vykonávat činnosti vyžadující bdělost se snižují.
Případy, kdy by neměl být podáván
Neměl by být používán u dětí mladších 12 let, protože může ovlivnit tvorbu kostí a jejich hustotu, protože mění koncentrace hormonu štítné žlázy. Rovněž má tendenci nahrazovat vápník v kostech..
Neměli by být léčeni LidvaCO3 lidé s kardiovaskulárním onemocněním, onemocněním ledvin nebo štítné žlázy. Ani u těžce dehydratovaných pacientů.
Neměl by být podáván těhotným ženám, zejména během prvního trimestru těhotenství. Lithium prochází placentou a může se snadno dostat k plodu s možnými teratogenními účinky, to znamená, že může způsobit abnormality nebo malformace nenarozeného dítěte..
Starší lidé vyžadující léčbu LidvaCO3 je třeba léčit velmi opatrně a v dávkách nižších, než jsou dávky u mladých dospělých, protože u nich se může vyvinout hypotyreóza.
Jiná použití
LidvaCO3 vysoká čistota je široce používána při výrobě dobíjecích lithiových baterií.
Používá se v roztavených karbonátových palivových článcích.
Používá se při výrobě elektrického porcelánu, což je druh elektricky izolačního porcelánu. Používá se také při výrobě glazury na keramice.

Umožňuje přípravu keramiky s nízkým koeficientem roztažnosti, to znamená, že se s rostoucí teplotou velmi málo rozpíná, takže lze keramiku použít ve vyšším teplotním rozsahu.
Jiná použití jsou jako katalyzátor, při výrobě jiných sloučenin lithia, jako povlak pro svařovací elektrody, v luminiscenčních nátěrových vzorcích, lacích a barvivech, jakož i při elektrolytické výrobě hliníku..
Je užitečné generovat rychlejší tuhnutí cementu a přidává se do lepidla dlaždic, aby bylo možné je za krátkou dobu zafixovat.

Reference
- Cai, W. a kol. (2018). Odstranění SO4dva- od LidvaCO3 rekrystalizací v NadvaCO3. Krystaly 2018, 8, 19. Obnoveno z mdpi.com.
- Gadikota, G. (2017). Spojení morfologických a krystalových strukturních změn během převodu monohydrátu hydroxidu lithného na uhličitan lithný pomocí vícenásobného měření rentgenového rozptylu. Minerály 2017, 7, 169. Obnoveno z mdpi.com.
- NÁS. Národní lékařská knihovna. (2019). Uhličitan lithný. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Čtvrté vydání. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Páté vydání. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.



Zatím žádné komentáře