
Vlastnosti, struktura, výroba, použití ethyletheru
The ethylether, také známý jako diethylether, je to organická sloučenina, jejíž chemický vzorec je C4H10O. Vyznačuje se tím, že je bezbarvá a těkavá kapalina, a proto by její lahve měly být udržovány co nejtěsněji uzavřené.
Tento ether je klasifikován jako člen dialkyletherů; to znamená, že mají vzorec ROR ', kde R a R' představují různé uhlíkové segmenty. A jak je popsáno pod druhým jménem, diethylether, jsou to dva-ethylové radikály, které se vážou na atom kyslíku.

Ethylether byl původně používán jako obecné anestetikum, které zavedl v roce 1846 William Thomas Green Morton. Vzhledem k jeho hořlavosti však bylo jeho použití vyřazeno a nahrazeno jinými méně nebezpečnými anestetiky..
Tato sloučenina se také používá k odhadu času krevního oběhu během hodnocení kardiovaskulárního stavu pacientů..
V těle může být diethylether přeměněn na oxid uhličitý a metabolity; poslední se vylučují močí. Většina podaného etheru je však vydechována do plic, aniž by došlo k jakékoli modifikaci..
Na druhé straně se používá jako rozpouštědlo pro mýdla, oleje, parfémy, alkaloidy a gumy..
Rejstřík článků
- 1 Struktura ethyletheru
- 1.1 Mezimolekulární síly
- 2 Fyzikální a chemické vlastnosti
- 2.1 Jiná jména
- 2.2 Molekulární vzorec
- 2.3 Molekulová hmotnost
- 2.4 Fyzický vzhled
- 2.5 Zápach
- 2.6 Příchuť
- 2.7 Bod varu
- 2.8 Teplota tání
- 2.9 Bod vzplanutí
- 2.10 Rozpustnost ve vodě
- 2.11 Rozpustnost v jiných kapalinách
- 2.12 Hustota
- 2.13 Hustota par
- 2.14 Tlak par
- 2.15 Stabilita
- 2.16 Automatické zapalování
- 2.17 Rozklad
- 2.18 Viskozita
- 2.19 Spalné teplo
- 2.20 Odpařovací teplo
- 2.21 Povrchové napětí
- 2.22 Ionizační potenciál
- 2.23 Prahová hodnota zápachu
- 2.24 Index lomu
- 3 Získání
- 3.1 Z ethanolu
- 3.2 Z ethylenu
- 4 Toxicita
- 5 použití
- 5.1 Organické rozpouštědlo
- 5.2 Celková anestézie
- 5.3 Duch éteru
- 5.4 Posouzení krevního oběhu
- 5.5 Výukové laboratoře
- 6 Reference
Struktura ethyletheru
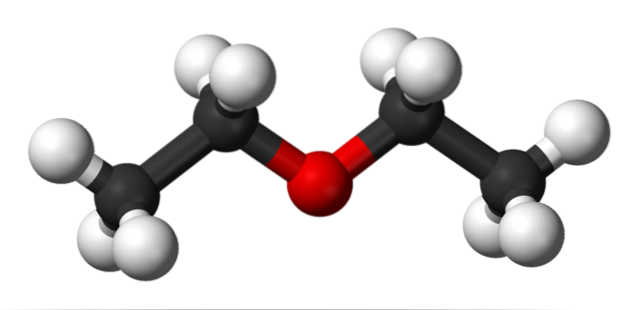
Na horním obrázku je znázornění s modelem koulí a pruhů molekulární struktury ethyletheru..
Jak je vidět, červená koule, odpovídající atomu kyslíku, má dvě ethylové skupiny spojené na obou stranách. Všechny odkazy jsou jednoduché, flexibilní a volně rotující kolem os σ.
Tyto rotace vedou ke vzniku stereoizomerů známých jako konforméry; že více než izomery jsou alternativními prostorovými stavy. Struktura obrazu přesně odpovídá antikonformátoru, ve kterém jsou všechny jeho skupiny atomů rozloženy (odděleny od sebe).
Co by to bylo za druhého konformátora? Zatměný, a přestože jeho obrázek není k dispozici, stačí jej vizualizovat ve tvaru U. Na horních koncích U jsou methylové skupiny, -CH3, které by zažily sterické odpudy (srazily se ve vesmíru).
Proto se očekává, že molekula CH3CHdvaOCHdvaCH3 většinu času si osvojte antiformování.
Mezimolekulární síly
Jakými mezimolekulárními silami se řídí molekuly ethyletheru v kapalné fázi? V kapalině se udržují hlavně díky disperzním silám, protože jejich dipólový moment (1,5 D) postrádá dostatečně deficitní oblast elektronové hustoty (δ +)
Je to proto, že žádný atom uhlíku v ethylových skupinách nevzdává příliš velkou hustotu elektronů atomu kyslíku. Výše uvedené je patrné z mapy elektrostatického potenciálu ethyletheru po ruce (spodní obrázek). Všimněte si absence modré oblasti.
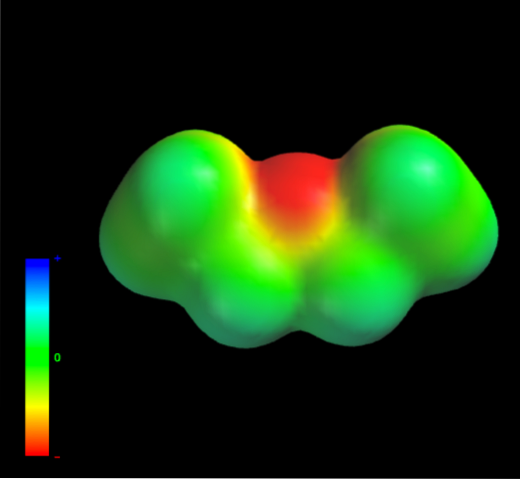
Kyslík také nemůže znovu vytvářet vodíkové vazby, protože v molekulární struktuře nejsou k dispozici žádné vazby O-H. Proto jsou to okamžité dipóly a jejich molekulová hmotnost, které upřednostňují jejich disperzní síly..
Navzdory tomu je vysoce rozpustný ve vodě. Proč? Protože jeho atom kyslíku s vyšší hustotou elektronů může přijímat vodíkové vazby z molekuly vody:
(CH3CHdva)dvaNEBOδ- - δ+H-OH
Tyto interakce jsou zodpovědné za 6,04 g tohoto etheru, který se rozpouští ve 100 ml vody.
Fyzikální a chemické vlastnosti
Ostatní jména
-Diethylether
-Ethoxyethan
-Ethyloxid
Molekulární vzorec
C4H10O nebo (C.dvaH5)dvaNEBO.
Molekulární váha
74,14 g / mol.
Fyzický vzhled
Bezbarvá kapalina.
Zápach
Sladké a pikantní.
Chuť
Hořící a sladké.
Bod varu
94,6 ° F (34,6 ° C) při 760 mmHg.
Bod tání
-176,3 ° F (-116,3 ° C). Stabilní krystaly.
bod vznícení
-49 ° F (uzavřená nádoba).
Rozpustnost ve vodě
6,04 g / 100 ml při 25 ° C.
Rozpustnost v jiných kapalinách
Mísitelný s alifatickými alkoholy s krátkým řetězcem, benzenem, chloroformem, petroletherem, tukovým rozpouštědlem, mnoha oleji a koncentrovanou kyselinou chlorovodíkovou.
Rozpustný v acetonu a velmi dobře rozpustný v ethanolu. Je také rozpustný v naftě, benzenu a olejích.
Hustota
0,714 mg / ml při 68 ° F (20 ° C).
Hustota par
2,55 (ve vztahu ke vzduchu nasávanému s hustotou 1).
Tlak páry
442 mmHg při 68 ° F. 538 mmHg při 25 ° C 58,6 kPa při 20 ° C.
Stabilita
Je pomalu oxidován působením vzduchu, vlhkosti a světla za tvorby peroxidů.
K tvorbě peroxidů může dojít v éterových nádobách, které byly otevřeny a které zůstaly skladovány déle než šest měsíců. Peroxidy lze odpálit třením, nárazem nebo zahřátím.
Vyvarujte se kontaktu s: zinek, halogeny, nekovové oxyhalogenidy, silná oxidační činidla, chromylchlorid, tementinové oleje, dusičnany a chloridy kovů.
Automatické zapalování
356 ° F (180 ° C).
Rozklad
Při zahřátí se rozkládá a vydává štiplavý a dráždivý kouř.
Viskozita
0,2448 cPoise při 20 ° C.
Spalné teplo
8,807 kcal / g.
Odpařovací teplo
89,8 kcal / g při 30 ° C.
Povrchové napětí
17,06 dyn / cm při 20 ° C.
Ionizační potenciál
9,53 eV.
Prahová hodnota zápachu
0,83 ppm (čistota není uvedena).
Index lomu
1355 při 15 ° C.
Získávání
Z ethanolu
Ethylether lze získat z ethylalkoholu v přítomnosti kyseliny sírové jako katalyzátoru. Kyselina sírová ve vodném médiu disociuje za vzniku hydroniového iontu, H3NEBO+.
Bezvodý ethylalkohol protéká roztokem kyseliny sírové zahřátý na 130 ° C až 140 ° C a vytváří protonaci molekul ethylalkoholu. Následně reaguje s protonovanou molekulou další molekula neproponovaného ethylalkoholu.
Když k tomu dojde, nukleofilní útok druhé molekuly ethylalkoholu podporuje uvolňování vody z první molekuly (protonované); výsledkem je protonovaný ethylether (CH3CHdvaOHCHdvaCH3), s částečně kladně nabitým kyslíkem.
Tato metoda syntézy však ztrácí účinnost, protože kyselina sírová se postupně ředí vodou vyrobenou v procesu (produkt dehydratace ethylalkoholu)..
Reakční teplota je kritická. Při teplotách pod 130 ° C je reakce pomalá a ethylalkohol bude z větší části destilován..
Při teplotě nad 150 ° C způsobuje kyselina sírová tvorbu ethylenu (alken s dvojnou vazbou), místo aby se kombinovala s ethylalkoholem za vzniku ethyletheru.
Z ethylenu
V opačném procesu, tj. Hydratace ethylenu v plynné fázi, může být kromě ethylalkoholu jako vedlejší produkt vytvořen ethylether. Ve skutečnosti tato syntetická cesta produkuje většinu této organické sloučeniny..
Tento proces používá katalyzátory na bázi kyseliny fosforečné připojené k pevnému podkladu, který lze upravit tak, aby vzniklo více etheru..
Dehydratace ethanolu v parní fázi v přítomnosti katalyzátorů na bázi oxidu hlinitého může poskytnout 95% výtěžek při výrobě ethyletheru..
Toxicita
Při kontaktu může způsobit podráždění pokožky a očí. Kontakt s pokožkou může způsobit vysušení a popraskání. Ether obvykle neproniká kůží, protože se rychle odpařuje.
Podráždění očí způsobené etherem je obvykle mírné a v případě silného podráždění je poškození obecně reverzibilní.
Jeho požití vyvolává narkotické účinky a podráždění žaludku. Silné požití může způsobit poškození ledvin.
Vdechnutí etheru může způsobit podráždění nosu a krku. V případě vdechnutí etheru se mohou objevit: ospalost, vzrušení, závratě, zvracení, nepravidelné dýchání a zvýšené slinění..
Vysoká expozice může způsobit ztrátu vědomí nebo dokonce smrt.
OSHA stanoví mezní expoziční limit ve vzduchu na 800 ppm v průměru za 8hodinovou směnu..
Úrovně podráždění očí: 100 ppm (člověk). Úrovně podráždění očí: 1200 mg / m3 (400 ppm).
Aplikace
Organické rozpouštědlo
Jedná se o organické rozpouštědlo, které se používá k rozpuštění bromu, jodu a dalších halogenů; většina lipidů (tuků), pryskyřice, čisté kaučuky, některé alkaloidy, gumy, parfémy, acetát celulózy, dusičnan celulózy, uhlovodíky a barviva.
Kromě toho se používá při extrakci účinných látek ze živočišných a rostlinných tkání, protože má nižší hustotu než voda a vznáší se na něm, takže požadované látky jsou rozpuštěny v etheru..
Celková anestezie
Používá se jako obecné anestetikum od roku 1840 a nahrazuje chloroform, protože má terapeutickou výhodu. Jedná se však o hořlavou látku, a proto má při používání v klinických podmínkách závažné potíže..
Kromě toho u pacientů vyvolává některé nežádoucí pooperační vedlejší účinky, jako je nevolnost a zvracení..
Z těchto důvodů bylo použití etheru jako obecného anestetika zlikvidováno a nahrazeno jinými anestetiky, jako je halothan..
Etherový duch
Ether smíchaný s ethanolem byl použit k vytvoření roztoku zvaného lihovina etheru, který se používá při léčbě plynatosti žaludku a mírnějších forem gastralgie..
Hodnocení krevního oběhu
Ether se používá k hodnocení krevního oběhu mezi pažemi a plícemi. Ether se vstřikuje do paže a přivádí krev do pravé síně, poté do pravé komory a odtud do plic..
Doba, která uplyne od vstřikování etheru do zachycení zápachu etheru ve vydechovaném vzduchu, je přibližně 4 až 6 s.
Výukové laboratoře
Ether se používá ve výukových laboratořích v mnoha experimentech; například při demonstraci Mendelových zákonů genetiky.
Ether se používá k uklidnění much rodu Drosophila a umožnění nezbytných křížení mezi nimi, čímž se prokazují zákony genetiky
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Sevier. (2018). Diethylether. Science Direct. Obnoveno z: sciencedirect.com
- Redaktoři Encyclopaedia Britannica. (2018). Ethylether. ncyclopædia Britannica. Obnoveno z: britannica.com
- PubChem (2018). Éter. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Diethylether. Obnoveno z: en.wikipedia.org
- Bezpečnostní list XI: ethylether. [PDF]. Obnoveno z: quimica.unam.mx


Zatím žádné komentáře