
Struktura karbidu vápníku (CaC2), vlastnosti, výroba, použití

The karbid vápníku Je to anorganická sloučenina tvořená prvky vápník (Ca) a uhlík (C). Jeho chemický vzorec je CaCdva. Je to pevná látka, která může být bezbarvá až nažloutlá nebo šedavě bílá a dokonce černá podle nečistot, které obsahuje.
Jedna z nejdůležitějších chemických reakcí CaCdva je to, co se stane s vodou HdvaNebo ve kterém se tvoří acetylen HC≡CH. Z tohoto důvodu se používá k získání acetylenu průmyslovým způsobem. Díky stejné reakci s vodou se používá k dozrávání ovoce, falešných zbraní a námořních světlic..

Reakce CaCdva s vodou také produkuje užitečný kal pro přípravu slínku (složka cementu), který produkuje méně oxidu uhličitého (COdva) ve srovnání s tradiční metodou výroby cementu.
S dusíkem (Ndva) karbid vápníku tvoří kyanamid vápenatý, který se používá jako hnojivo. CaCdva také se používá k odstranění síry z určitých kovových slitin.
Před nějakou dobou CaCdva Používal se v takzvaných karbidových lampách, ale ty už nejsou příliš běžné, protože jsou nebezpečné.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Hustota
- 3.6 Chemické vlastnosti
- 4 Získání
- 5 použití
- 5.1 Při výrobě acetylenu
- 5.2 Při snižování emisí CO2
- 5.3 Při získávání kyanamidu vápenatého
- 5.4 V metalurgickém průmyslu
- 5.5 V různých použitích
- 5.6 Ukončení používání
- 6 Rizika
- 7 Reference
Struktura
Karbid vápníku je iontová sloučenina a je tvořena iontem vápníku Cadva+ a karbidový nebo acetylidový iont Cdvadva-. Karbidový iont je tvořen dvěma atomy uhlíku spojenými trojnou vazbou.
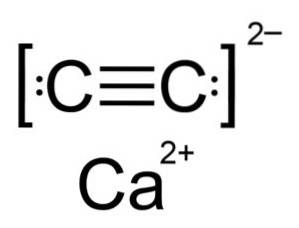
Krystalová struktura CaCdva je odvozen z krychle (jako chlorid sodný NaCl), ale jako iont C.dvadva- je protáhlá, struktura je zkreslená a stává se čtyřboká.
Nomenklatura
- Karbid vápníku
- Karbid vápníku
- Acetylid vápenatý
Vlastnosti
Fyzický stav
Krystalická pevná látka, která, pokud je čistá, je bezbarvá, ale pokud je kontaminována jinými sloučeninami, může mít nažloutlou bílou nebo šedavě až černou barvu.

Molekulární váha
64,0992 g / mol
Bod tání
2160 ° C
Bod varu
CaCdva vaří při 2300 ° C za rozkladu. Bod varu musí být měřen v inertní atmosféře, tj. Bez kyslíku nebo vlhkosti..
Hustota
2,22 g / cm3
Chemické vlastnosti
Karbid vápníku reaguje s vodou za vzniku acetylenu HC≡CH a hydroxidu vápenatého Ca (OH)dva:
CaCdva + 2 hdvaO → HC≡CH + Ca (OH)dva
Acetylen je hořlavý, proto CaC za přítomnosti vlhkostidva může být hořlavý. Když je však sucho, není.

Karbid vápníku reaguje s dusíkem Ndva za vzniku kyanamidu vápenatého CaCNdva:
CaCdva + Ndva → CaCNdva + C
Získávání
Karbid vápníku se průmyslově vyrábí v elektrické obloukové peci vycházející ze směsi uhličitanu vápenatého (CaCO3) a uhlík (C), který je vystaven teplotě 2 000 ° C. Reakce je shrnuta takto:
Zloděj3 + 3 C → CaCdva + CO ↑ + COdva↑
Nebo také:
CaO + 3 C → CaCdva + CO ↑
V elektrické obloukové peci se vytváří elektrický oblouk mezi dvěma grafitovými elektrodami, které odolávají vznikajícím vysokým teplotám. Získá se karbid vápníku s 80-85% čistotou.
Aplikace
Při výrobě acetylenu
Průmyslově se reakce karbidu vápníku s vodou používá k výrobě acetylenu C.dvaHdva.
CaCdva + 2 hdvaO → HC≡CH + Ca (OH)dva
Toto je nejdůležitější použití karbidu vápníku. V některých zemích je acetylen vysoce ceněn, protože umožňuje vyrábět polyvinylchlorid, což je druh plastu. Kromě toho se acetylen používá ke svařování při vysokých teplotách.

Při snižování emisí COdva
Zbytky získané při získávání acetylenu z CaCdva (také nazývané „kal z karbidu vápníku“ nebo „zbytky karbidu vápníku“) se používají k získání slínku nebo betonu.
Bahno z karbidu vápníku má vysoký obsah hydroxidu vápenatého (Ca (OH)dva) (asi 90%), část uhličitanu vápenatého (CaCO3) a má pH vyšší než 12.

Z těchto důvodů může reagovat se SiOdva nebo AldvaNEBO3 vytvoření produktu podobného produktu získanému procesem hydratace cementu.
Jedna z lidských činností, která produkuje nejvíce emisí COdva je to stavební průmysl. COdva se generuje na východ a oddělí se od uhličitanu vápenatého během reakce za vzniku betonu.
Použití kalu karbidu vápníku k nahrazení uhličitanu vápenatého (CaCO3) bylo zjištěno, že snižuje emise COdva o 39%.
Při získávání kyanamidu vápenatého
Karbid vápníku se také průmyslově používá k získání kyanamidu vápenatého CaCNdva.
CaCdva + Ndva → CaCNdva + C
Kyanamid vápenatý se používá jako hnojivo, protože s půdní vodou se přeměňuje na kyanamid H2N = C = N, který poskytuje rostlinám dusík, což je pro ně základní živina.
V metalurgickém průmyslu
Karbid vápníku se používá k odstranění síry ze slitin, jako je feronikl. CaC je smíšenýdva slitinou roztavenou při 1550 ° C Síra (S) reaguje s karbidem vápníku a produkuje sirník vápenatý CaS a uhlík C:
CaCdva + S → 2 C + CaS
Odstranění síry je výhodné, pokud je míchání účinné a obsah uhlíku ve slitině je nízký. Sulfid vápenatý CaS plave na povrchu roztavené slitiny, odkud se dekantuje a likviduje..
V různých použitích
Karbid vápníku se používá k odstranění síry ze železa. Také jako palivo při výrobě oceli a jako silný deoxidátor.
Používá se k dozrávání ovoce. Acetylen se vytváří z karbidu vápníku ve vodě, což indukuje zrání plodů, jako jsou banány..

Karbid vápníku se používá v atrapách zbraní, aby způsobil hlasitý třesk, který je charakterizuje. Zde se také používá tvorba acetylenu, který exploduje s jiskrou uvnitř zařízení.
CaCdva slouží ke generování signálů na moři v samozápalných námořních erupcích.
Ukončení používání
CaCdva používá se v takzvaných karbidových lampách. Jejich provoz spočívá v kapání vody na karbid vápníku za vzniku acetylenu, který se zapaluje a tímto způsobem poskytuje světlo.
Tyto lampy se používaly v uhelných dolech, ale jejich používání bylo přerušeno kvůli přítomnosti metanového plynu CH4 v těchto dolech. Tento plyn je hořlavý a plamen z karbidové výbojky může způsobit jeho vznícení nebo výbuch..

Byly široce používány v břidlicových, měděných a cínových kamenných dolech a také v časných automobilech, motocyklech a jízdních kolech jako světlomety nebo světlomety.
V současné době byly nahrazeny elektrickými žárovkami nebo dokonce LED žárovkami. Stále se však používají v zemích, jako je Bolívie, ve stříbrných dolech v Potosí.
Rizika
Karbid vápníku CaCdva suchý není hořlavý, ale za přítomnosti vlhkosti rychle vytváří acetylen, což je.
Uhasit oheň za přítomnosti CaCdva nikdy byste neměli používat vodu, pěnu, oxid uhličitý nebo halogenové hasicí přístroje. Měl by být použit písek nebo hydroxid sodný nebo vápenatý.
Reference
- Ropp, R.C. (2013). Skupina 14 (C, Si, Ge, Sn a Pb) sloučeniny alkalických zemin. Karbidy vápníku. In Encyclopedia of the Alkaline Earth Compounds. Obnoveno ze sciencedirect.com.
- Pohanish, R. P. (2017). C. Karbid vápníku. V Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens (Sedmé vydání). Obnoveno ze sciencedirect.com.
- Sun, H. a kol. (2015). Vlastnosti chemicky spáleného zbytku karbidu vápníku a jeho vliv na vlastnosti cementu. Materiály 2015, 8, 638-651. Obnoveno z ncbi.nlm.nih.gov.
- Nie, Z. (2016). Ekologické materiály a hodnocení životního cyklu. Případová studie: COdva Analýza emisí kalového slinku z karbidu vápníku. In Green and Sustainable Manufacturing of Advanced Material. Obnoveno ze sciencedirect.com.
- Crundwell, F.K. Et al. (2011). Zušlechťování roztaveného ferroniklu. Odstranění síry. In Extractive Metalurgy of Nickel, Cobalt and Platinum Group Metals. Obnoveno ze sciencedirect.com.
- Tressler, R.E. (2001). Strukturální a termostrukturální keramika. Karbidy. In Encyclopedia of Materials Science and Technology. Obnoveno ze sciencedirect.com.
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.



Zatím žádné komentáře