
Vlastnosti, použití, struktury, rizika, kyanid draselný (KCN),
The kyanid draselný je anorganická sloučenina tvořená iontem draslíku K.+ a kyanidový ion CN-. Jeho chemický vzorec je KCN. Je to bílá krystalická pevná látka, extrémně jedovatá.
KCN je velmi rozpustný ve vodě a po rozpuštění hydrolyzuje za vzniku kyseliny kyanovodíkové nebo kyanovodíku HCN, který je také velmi jedovatý. Kyanid draselný může tvořit sloučeninové soli se zlatem a stříbrem, proto se dříve používal k extrakci těchto drahých kovů z určitých minerálů..

KCN se používá k potažení levných kovů zlatem a stříbrem elektrochemickým procesem, tj. Metodou, při které elektrický proud prochází roztokem obsahujícím sůl tvořenou drahým kovem, kyanidem a draslíkem..
S kyanidem draselným, protože obsahuje kyanid, je třeba zacházet velmi opatrně a s vhodnými nástroji. Nikdy by neměl být likvidován do životního prostředí, protože je také velmi toxický pro většinu zvířat a rostlin..
Jsou však studovány metody využívající běžné řasy k odstranění kyanidu draselného z vod kontaminovaných nízkými koncentracemi kyanidu draselného..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Hustota
- 3.6 Rozpustnost
- 3,7 pH
- 3.8 Hydrolýzní konstanta
- 3.9 Chemické vlastnosti
- 3.10 Další vlastnosti
- 4 Získání
- 5 Použití při galvanickém pokovování kovů
- 5,1 stříbra
- 5,2 zlata
- 5.3 Jiná použití
- 6 Rizika
- 7 Mechanismus účinku
- 7.1 Další rizika
- 8 Nedávné studie
- 9 Odkazy
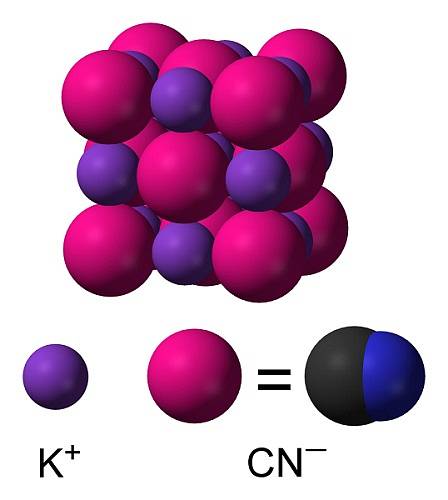
Struktura
KCN je iontová sloučenina vytvořená kationem draslíku K.+ a kyanidový anion CN-. V tomto je atom uhlíku spojen s atomem dusíku trojnou kovalentní vazbou..

V pevném kyanidu draselném anion CN- Může se volně otáčet, takže se chová jako sférický anion, v důsledku toho má krystal KCN podobu kubickou podobnou jako chlorid draselný KCl.
Nomenklatura
- Kyanid draselný
- Kyanid draselný
- Kyanodraslík
Vlastnosti
Fyzický stav
Bílá krystalická pevná látka. Krychlové krystaly.
Molekulární váha
65,116 g / mol.
Bod tání
634,5 ° C
Bod varu
1625 ° C.
Hustota
1,55 g / cm3 při 20 ° C.
Rozpustnost
Velmi dobře rozpustný ve vodě: 716 g / l při 25 ° C a 100 g / 100 ml vody při 80 ° C. Mírně rozpustný v methanolu: 4,91 g / 100 g methanolu při 19,5 ° C. Velmi málo rozpustný v ethanolu: 0,57 g / 100 g ethanolu při 19,5 ° C.
pH
Vodný roztok 6,5 g KCN v 1 1 vody má pH 11,0.
Konstanta hydrolýzy
KCN je velmi rozpustný ve vodě. Když se rozpustí, je kyanidový ion CN volný- který bere proton H+ vody za vzniku kyseliny kyanovodíkové HCN a uvolnění iontu OH-:
CN- + HdvaO → HCN + OH-
Hydrolýzní konstanta označuje tendenci, s níž se uvedená reakce provádí.
K.h = 2,54 x 10-5
Vodné roztoky KCN uvolňují kyanovodík HCN do okolního prostředí při zahřátí nad 80 ° C.
Chemické vlastnosti
Není hořlavý, ale při zahřátí pevného KCN na rozklad vydává velmi toxické plyny kyanovodík HCN, oxidy dusíku NOX, oxid draselný K.dvaO a oxid uhelnatý CO.
KCN reaguje se solemi zlata za vzniku aurokyanidu draselného KAu (CN)dva a draselné atrium KAu (CN)4. Jedná se o bezbarvé komplexní soli. Se stříbrným kovem Ag tvoří KCN argentokyanid draselný KAg (CN)dva.
Kyanidový ion KCN reaguje s určitými organickými sloučeninami, které mají halogeny (jako je chlor nebo brom), a nahrazuje je. Například reaguje s kyselinou bromoctovou za vzniku kyseliny kyanooctové..
Další vlastnosti
Je hygroskopický, absorbuje vlhkost z prostředí.
Má mírný hořký mandlový zápach, ale to není detekováno všemi lidmi.
Získávání
KCN se připravuje reakcí hydroxidu draselného KOH ve vodném roztoku s kyanovodíkem HCN. Získává se také zahříváním ferokyanidu draselného K.4Víra (CN)6:
K.4Víra (CN)6 → 4 KCN + 2 C + Ndva↑ + víra
Použití při galvanickém pokovování kovů
Používá se při procesu potahování kovů s nízkou hodnotou zlatem a stříbrem. Jedná se o elektrolytický proces, to znamená, že elektřina prochází vodným roztokem s vhodnými solemi.
stříbrný
Používá se argentokyanid draselný KAg (CN)dva pro stříbření (Ag) levnějších kovů.
Ty se umístí do vodného roztoku argentokyanidu draselného KAg (CN)dva, kde anoda nebo kladný pól je tyč z čistého stříbra (Ag) a katoda nebo záporný pól je levný kov, který chcete pokrýt stříbrem.
Při průchodu elektrického proudu roztokem se stříbro ukládá na druhý kov. Při použití kyanidových solí se vrstva stříbra ukládá jemnějším, kompaktnějším a přilnavějším způsobem než v roztocích jiných sloučenin..

Zlato
Podobně v případě zlata (Au), aurokyanid draselný KAu (CN)dva a draselné atrium KAu (CN)4 se používají k elektrolytickému zlacení jiných kovů.

Jiná použití
Zde jsou některá další použití kyanidu draselného.
- Pro průmyslový proces kalení oceli nitridací (přidání dusíku).
- Pro čištění kovů.
- V tiskových a fotografických procesech.
- Dříve to bylo používáno pro těžbu zlata a stříbra z minerálů, které je obsahují, ale později to bylo nahrazeno kyanidem sodným NaCN, který je levnější, i když stejně toxický.
- Jako insekticid pro postřik stromů, lodí, železničních vozů a skladů.
- Jako činidlo v analytické chemii, to znamená provádět chemickou analýzu.
- K přípravě dalších chemických sloučenin, jako jsou barviva a barviva.

Rizika
KCN je velmi jedovatá sloučenina pro zvířata, většinu rostlin a mikroorganismy. Je klasifikován jako super toxický. Je smrtelný i ve velmi malém množství.
K jeho škodlivému účinku může dojít při vdechování, kontaktu s pokožkou nebo očima nebo požití. Inhibuje mnoho metabolických procesů, zejména krevní proteiny podílející se na transportu kyslíku, jako je hemoglobin.
Ovlivňuje orgány nebo systémy nejcitlivější na nedostatek kyslíku, jako je centrální nervový systém (mozek), kardiovaskulární systém (srdce a krevní cévy) a plíce.

Mechanismus účinku
KCN narušuje schopnost těla využívat kyslík.
Kyanidový ion CN- KCN má vysokou afinitu k železitému iontu Fe3+, což znamená, že když je kyanid absorbován, reaguje rychle s Fe3+ krve a tkání.
Tímto způsobem zabraňuje dýchání buněk, které vstupují do stavu nedostatku kyslíku, protože i když se snaží dýchat, nemohou je použít..
Pak existuje přechodný stav hyperapnoe (pozastavení dýchání) a bolesti hlavy a nakonec smrt v důsledku zástavy dýchání..
Další rizika
Při zahřátí produkuje velmi toxické plyny, jako je HCN, oxidy dusíku NOX, oxid draselný K.dvaO a oxid uhelnatý CO.
Při kontaktu s vlhkostí uvolňuje HCN, který je vysoce hořlavý a velmi toxický..
KCN je také velmi jedovatý pro vodní organismy. Nikdy by neměl být likvidován do životního prostředí, protože může dojít ke kontaminaci vod, kde pijí zvířata a kde žijí ryby.
Existují však bakterie, které produkují kyanid, jako např Chromobacterium violaceum a některé druhy Pseudomonas.
Nedávné studie
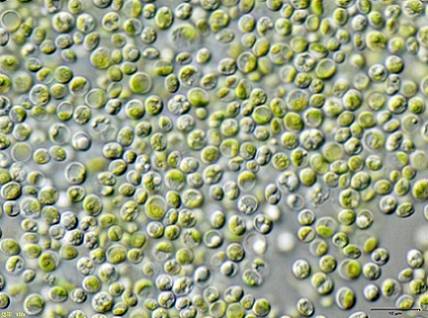
Někteří vědci zjistili, že zelené řasy Chlorella vulgaris lze použít k úpravě vody kontaminované KCN kyanidem draselným v nízkých koncentracích.
Řasy dokázaly účinně odstranit KCN, protože to v malém množství stimulovalo růst řas, protože aktivovalo vnitřní mechanismus, aby odolávalo toxicitě KCN.
To znamená, že řasa Chlorella vulgaris má potenciál odstranit kyanid a že by s tím mohla být navržena účinná metoda biologického čištění kontaminace kyanidem.
Reference
- NÁS. Národní lékařská knihovna. (2019). Kyanid draselný. Národní centrum pro biotechnologické informace. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Coppock, R.W. (2009). Hrozby pro divokou zvěř agenty chemické války. In Handbook of Toxicology of Chemical Warfare Agents. Obnoveno ze sciencedirect.com.
- Liu, Q. (2017). Hodnocení odstranění kyanidu draselného a jeho toxicity v zelených řasách (Chlorella vulgaris). Bull Environ Contam Toxicol. 2018; 100 (2): 228-233. Obnoveno z ncbi.nlm.nih.gov.
- Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH). (2011). Kyanid draselný: systémové činidlo. Obnoveno z cdc.gov.
- Alvarado, L.J. et al. (2014). Riboswitch Discovery, struktura a funkce. Syntéza Uracilu. In Metody v enzymologii. Obnoveno ze sciencedirect.com.



Zatím žádné komentáře