
Charakteristika cykloalkinů, aplikace, příklady
The cykloalkiny Jsou to organické sloučeniny, které mají jednu nebo více trojných vazeb a cyklickou jednotku. Jeho kondenzované molekulární vzorce se řídí vzorcem C.nH2n-4. Pokud je tedy n rovno 3, pak vzorec uvedeného cykloalkinu bude C3Hdva.
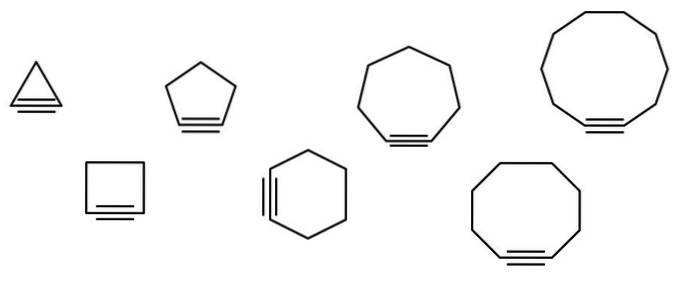
Na obrázku níže je znázorněna řada geometrických obrazců, ale ve skutečnosti se skládají z příkladů cykloalkinů. Každý z nich lze považovat za více oxidovanou verzi příslušných cykloalkanů (bez dvojných nebo trojných vazeb). Pokud jim chybí heteroatom (O, N, S, F atd.), Jsou to jen „jednoduché“ uhlovodíky..
Chemie kolem cykloalkinů je velmi složitá a mechanismy jejich reakcí jsou ještě složitější. Představují výchozí bod pro syntézu mnoha organických sloučenin, které jsou zase předmětem možných aplikací.
Obecně lze říci, že jsou vysoce reaktivní, pokud nejsou „zkreslené“ nebo komplexované s přechodnými kovy. Podobně mohou být jeho trojné vazby konjugovány s dvojnými vazbami, čímž se v molekulách vytvoří cyklické jednotky..
Pokud tomu tak není, jsou ve svých nejjednodušších strukturách schopny přidávat malé molekuly ke svým trojným vazbám..
Rejstřík článků
- 1 Charakteristika cykloalkinů
- 1.1 Apolarita a trojná vazba
- 1.2 Mezimolekulární síly
- 1.3 Úhlové napětí
- 2 Názvosloví
- 3 Aplikace
- 4 příklady
- 5 Reference
Charakteristika cykloalkinů
Apolarita a trojná vazba
Cykloalkiny jsou charakterizovány tím, že jsou nepolární molekuly, a proto jsou hydrofobní. To se může změnit, pokud mají ve svých strukturách nějaký heteroatom nebo funkční skupinu, která jim dává značný dipólový moment; jak se to děje v heterocyklech s trojnými vazbami.
Ale co je to trojné pouto? Nejsou to více než tři současné interakce mezi dvěma atomy uhlíku s hybridizací sp. Jedna vazba je jednoduchá (σ) a další dvě π jsou na sebe kolmé. Oba atomy uhlíku mají volný sp orbitál pro vazbu s jinými atomy (R-C≡C-R).
Tyto hybridní orbitaly mají 50% s charakter a 50% p znak. Protože s orbitaly jsou pronikavější než p, tato skutečnost činí dva uhlíky trojné vazby kyselějšími (akceptory elektronů) než uhlíky alkanů nebo alkenů..
Z tohoto důvodu představuje trojná vazba (≡) specifický bod pro přidání druhů elektronových donorů k vytvoření jednoduchých vazeb..
To má za následek rozbití jedné z π vazeb, čímž se stane dvojná vazba (C = C). Přidávání pokračuje až do R4C-CR4, tj. plně nasycené uhlíky.
Výše uvedené lze také vysvětlit tímto způsobem: trojná vazba je dvojná nenasycenost.
Mezimolekulární síly
Molekuly cykloalkinu interagují prostřednictvím rozptylových sil nebo londýnských sil a interakcí typu π-π. Tyto interakce jsou slabé, ale s rostoucí velikostí cyklů (jako poslední tři na pravé straně obrázku) se jim podaří vytvářet pevné látky při pokojové teplotě a tlaku..
Úhlové napětí
Vazby v trojné vazbě jsou umístěny na stejné rovině a linii. Proto má -C≡C- lineární geometrii s orbitály sp oddělenými přibližně o 180 °.
To má vážný dopad na stereochemickou stabilitu cykloalkinů. „Ohýbat“ orbitaly sp vyžaduje mnoho energie, protože nejsou pružné.
Čím menší je cykloalkin, tím více sp orbitálů se musí ohýbat, aby umožnil jeho fyzickou existenci. Z analýzy obrazu je patrné, zleva doprava, že v trojúhelníku je úhel vazeb ke stranám trojné vazby velmi výrazný; zatímco v dekagonu jsou méně strmé.
Čím větší je cykloalkin, tím blíže se úhel vazby sp orbitalů blíží ideálním 180 °. Opak je, když jsou menší, nutí je ohýbat se a vytvářejí a úhlové napětí v nich destabilizuje cykloalkin.
Velké cykloalkiny tedy mají nižší úhlové napětí, což umožňuje jejich syntézu a ukládání. Díky tomu je trojúhelník nejstabilnější cykloalkin a dekagon nejstabilnější ze všech..
Ve skutečnosti je cyklooktino (ten s osmiúhelníkem) nejmenší a nejstabilnější známé velikosti; ostatní existují pouze jako dočasní prostředníci chemických reakcí.
Nomenklatura
Pro pojmenování cykloalkinů musí být použity stejné standardy IUPAC jako pro cykloalkany a cykloalkeny. Jediný rozdíl spočívá v příponě -ico na konci názvu organické sloučeniny..
Hlavní řetězec je ten, který má trojnou vazbu a začíná se číslovat od konce nejblíže k němu. Pokud máte například cyklopropan, pak se trojná vazba bude nazývat cyklopropino (trojúhelník na obrázku). Pokud je methylová skupina připojena k vrcholovému vrcholu, pak to bude: 2-methylcyklopropino.
Uhlíky R-C≡C-R již mají své čtyři vazby, takže mu chybí vodíky (jako je tomu u všech cykloalkinů na obrázku). K tomu nedochází, pouze pokud je trojná vazba v koncové poloze, tj. Na konci řetězce (R-C≡C-H).
Aplikace
Cykloalkiny nejsou příliš běžné sloučeniny, takže ani jejich aplikace. Mohou sloužit jako pojiva (skupiny, které koordinují) přechodných kovů, čímž vytvářejí nekonečno organokovových sloučenin, které lze použít pro velmi přísné a specifické použití..
Obvykle jsou to rozpouštědla v jejich nejvíce nasycených a stabilních formách. Když se skládají z heterocyklů, kromě toho, že mají vnitřní cyklické jednotky C≡C-C = C-C≡C, najdou zajímavé a slibné použití jako protirakovinné léky; To je případ Dinemycinu A. Byly z něj syntetizovány další sloučeniny se strukturálními analogiemi..
Příklady
Obrázek ukazuje sedm jednoduchých cykloalkinů, ve kterých je stěží jedna trojná vazba. Zleva doprava s příslušnými jmény jsou: cyklopropino, trojúhelník; cyklobutino, náměstí; cyklopentin, pětiúhelník; cyklohexin, šestiúhelník; cykloheptin, heptagon; cyklooktino, osmiúhelník; a cyklodecino, dekagon.
Na základě těchto struktur a nahrazením atomů vodíku nasycených uhlíků lze získat další sloučeniny z nich odvozené. Mohou být také vystaveny oxidačním podmínkám, aby se vytvořily dvojné vazby na jiných stranách cyklů..
Tyto geometrické jednotky mohou být součástí větší struktury, což zvyšuje šance na funkčnost celé sady. Není k dispozici mnoho příkladů cykloalkinů, alespoň ne bez ponoření se do hlubokých říší organické syntézy a farmakologie..
Reference
- Francis A. Carey. Organická chemie. (Šesté vydání, str. 372, 375). Mc Graw Hill.
- Wikipedia. (2018). Cykloalkyn. Převzato z: en.wikipedia.org
- William Reusch. (5. května 2013). Pojmenování organických sloučenin. Převzato z: 2.chemistry.msu.edu
- Anorganická chemie. Cykloalkiny. Převzato z: fullquimica.com
- Patrizia Diana a Girolamo Cirrincione. (2015). Biosyntéza heterocyklů z izolace na genovou shluk. Wiley, strana 181.
- Zajímavá organická chemie a přírodní produkty. (2015, 17. dubna). Cykloalkyny. Převzato z: quintus.mickel.ch



Zatím žádné komentáře