
Struktura, vlastnosti a použití cyklopentanu (C5H10)
The cyklopentan jedná se o cyklický uhlovodík, konkrétně o cykloalkan. Na druhé straně je to organická sloučenina, jejíž molekulární vzorec je C5H10. Lze jej považovat za uzavřenou verzi n-pentan, otevřený řetězec, ve kterém byly jeho konce spojeny ztrátou dvou atomů vodíku.
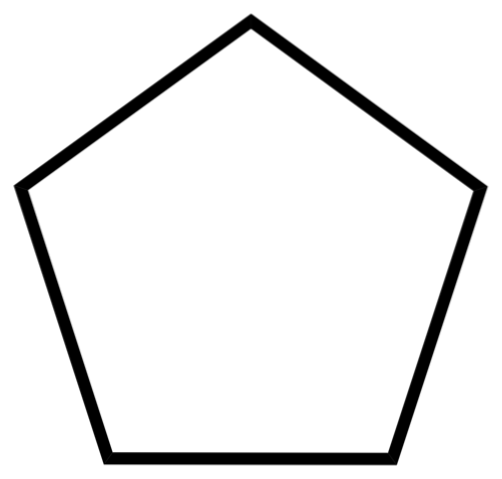
Dolní obrázek ukazuje kostru cyklopentanu. Všimněte si, jak geometricky vypadá jeho kostra a tvoří pětiúhelníkový prsten. Jeho molekulární struktura však není plochá, nýbrž představuje záhyby, které se snaží stabilizovat a snížit napětí uvnitř kruhu. Cyklopentan je vysoce těkavá a hořlavá kapalina, ale není tak hořlavá jako n-pentan.
Díky své kapacitě rozpouštědel je cyklopentan jedním z nejpoužívanějších rozpouštědel v chemickém průmyslu. Není divu, že mnoho produktů se silným zápachem ho obsahuje ve svém složení, a proto je hořlavé. Používá se také jako nadouvadlo pro polyuretanové pěny používané v chladničkách..
Rejstřík článků
- 1 Struktura cyklipentanu
- 1.1 Intermolekulární interakce
- 1.2 Konformace a namáhání prstence
- 2 Vlastnosti cyklipentanu
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Bod tání
- 2.4 Bod varu
- 2.5 Bod vzplanutí
- 2.6 Teplota samovznícení
- 2.7 Odpařovací teplo
- 2.8 Viskozita
- 2.9 Index lomu
- 2.10 Tlak par
- 2.11 Hustota
- 2.12 Rozpustnost
- 2,13 Rozdělovací koeficient oktanol / voda
- 2.14 Reaktivita
- 3 použití
- 3.1 Průmyslové rozpouštědlo
- 3.2 Zdroj ethylenu
- 3.3 Izolační polyuretanové pěny
- 4 Odkazy
Struktura cyklipentanu
Intermolekulární interakce
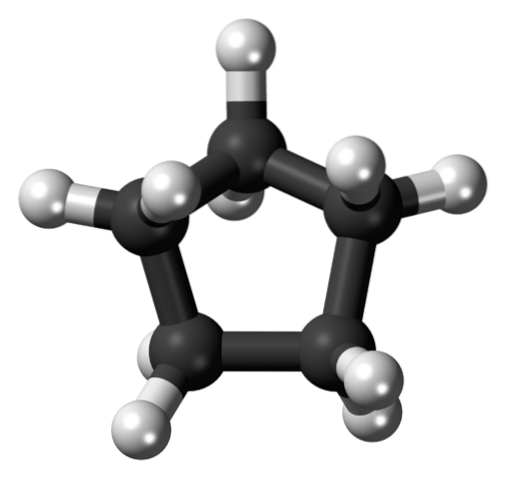
Na prvním obrázku byla zobrazena kostra cyklopentanu. Nahoře nyní vidíme, že je to víc než jednoduchý pětiúhelník: atomy vodíku (bílé koule) vyčnívají na jeho okrajích, zatímco atomy uhlíku tvoří pětiúhelníkový kruh (černé koule).
Tím, že mají pouze vazby C-C a C-H, je jejich dipólový moment zanedbatelný, takže molekuly cyklopentanu nemohou vzájemně interagovat prostřednictvím dipól-dipólových sil. Místo toho jsou drženi pohromadě díky londýnským disperzním silám a prsteny se pokoušejí skládat na sebe..
Toto stohování nabízí větší kontaktní plochu, než je k dispozici mezi lineárními molekulami molekuly n-pentan. V důsledku toho má cyklopentan vyšší teplotu varu než n-pentan, jakož i nižší tlak par.
Disperzní síly jsou zodpovědné za cyklopentan, který po zmrazení na -94 ° C vytvoří molekulární krystal. Ačkoli není mnoho informací o jeho krystalické struktuře, je polymorfní a má tři fáze: I, II a III, přičemž fáze II je neuspořádanou směsí I a III.
Konformace a napětí v kruhu
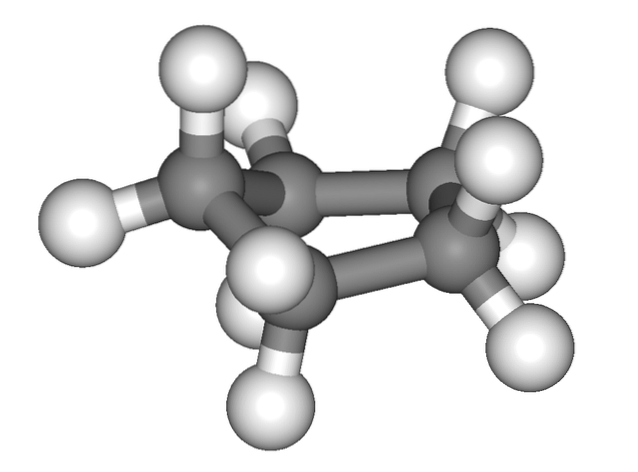
Obrázek výše dává mylný dojem, že cyklopentan je plochý; ale není to tak. Všechny jeho atomy uhlíku mají sp hybridizaci3, takže jejich orbitaly nejsou ve stejné rovině. Také, jako by to nestačilo, jsou atomy vodíku velmi blízko u sebe, jsou silně odpuzovány, když jsou zastíněny..
Mluvíme tedy o konformacích, jednou z nich je poloviční židle (horní obrázek). Z této perspektivy je jasně oceněno, že cyklopentanový kruh má ohyby, které pomáhají snižovat jeho napětí v kruhu díky jeho atomům uhlíku tak blízko u sebe..
Toto napětí je způsobeno skutečností, že vazby C-C představují úhly menší než 109,5 °, což je ideální hodnota pro čtyřboké prostředí v důsledku jejich sp hybridizace.3.
Navzdory tomuto stresu je však cyklopentan stabilnější a méně hořlavá sloučenina než pentan. To lze ověřit porovnáním jejich bezpečnostních diamantů, ve kterých je hořlavost cyklopentanu 3, zatímco pentanu 4.
Vlastnosti cyklipentanu
Fyzický vzhled
Bezbarvá kapalina s jemným ropným zápachem.
Molární hmotnost
70,1 g / mol
Bod tání
-93,9 ° C
Bod varu
49,2 ° C
Bod vzplanutí
-37,2 ° C
teplota samovznícení
361 ° C
Odpařovací teplo
28,52 kJ / mol při 25 ° C
Viskozita
0,413 mPa s
Index lomu
1,4065
Tlak páry
45 kPa při 20 ° C Tento tlak odpovídá asi 440 atm, je však nižší než tlak n-Pentan: 57,90 kPa.
Zde se projevuje účinek struktury: cyklopentanový kruh umožňuje účinnější intermolekulární interakce, které váží a zadržuje více svých molekul v kapalině ve srovnání s lineárními molekulami n-pentan. Proto má druhý z nich vyšší tlak par.
Hustota
0,751 g / cm3 při 20 ° C Na druhé straně jsou jeho páry 2,42krát hustší než vzduch.
Rozpustnost
V jednom litru vody o teplotě 25 ° C se díky hydrofobní povaze rozpustí pouze 156 mg cyklopentanu. Je však mísitelný s nepolárními rozpouštědly, jako jsou jiné parafiny, ethery, benzen, tetrachlormethan, aceton a ethanol..
Rozdělovací koeficient oktanol / voda
3
Reaktivita
Při správném skladování je cyklopentan stabilní. Není to reaktivní látka, protože její vazby C-H a C-C není snadné rozbít, i když by to vedlo k uvolnění energie způsobené napětím prstence.
V přítomnosti kyslíku bude hořet při spalovací reakci, ať už úplné nebo neúplné. Protože cyklopentan je velmi těkavá sloučenina, musí být skladován na místech, kde nemůže být vystaven žádnému zdroji tepla..
Mezitím cyklopentan v nepřítomnosti kyslíku podstoupí pyrolýzní reakci a rozloží se na menší a nenasycené molekuly. Jedním z nich je 1-penten, který ukazuje, že teplo rozbíjí cyklopentanový kruh za vzniku alkenu.
Na druhou stranu může cyklopentan reagovat s bromem pod ultrafialovým zářením. Tímto způsobem je jedna z jeho vazeb C-H nahrazena C-Br, kterou lze zase nahradit jinými skupinami; a tak vznikají deriváty cyklopentanu.
Aplikace
Průmyslové rozpouštědlo
Hydrofobní a nepolární charakter cyklopentanu z něj dělá odmašťovací rozpouštědlo spolu s dalšími parafinickými rozpouštědly. Z tohoto důvodu je obvykle součástí složení mnoha produktů, jako jsou lepidla, syntetické pryskyřice, barvy, lepidla, tabák a benzín..
Zdroj ethylenu
Když je cyklopentan podroben pyrolýze, jednou z nejdůležitějších látek, které generuje, je ethylen, který má nespočet aplikací ve světě polymerů..
Izolační polyuretanové pěny
Jedno z nejpozoruhodnějších použití cyklopentanu je jako nadouvadlo pro výrobu izolačních polyurethanových pěn; to znamená, že výpary cyklopentanu díky svému vysokému tlaku rozpínají polymerní materiál, dokud nevytvoří pěnu s příznivými vlastnostmi pro použití v rámci chladniček nebo mrazniček.
Některé společnosti se při výrobě izolačních materiálů rozhodly nahradit HFC cyklopentanem, protože to nepřispívá ke zhoršení ozonové vrstvy a také snižuje uvolňování skleníkových plynů do životního prostředí..
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Wikipedia. (2020). Cyklopentan. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2020). Cyklopentan. Databáze PubChem, CID = 9253. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Cyklopentan. ScienceDirect. Obnoveno z: sciencedirect.com
- Zařízení GE. (2011, 11. ledna). Snižování emisí skleníkových plynů ve výrobních závodech GE na výrobu chladniček. Obnoveno z: pressroom.geappliances.com


Zatím žádné komentáře