
Struktura, vlastnosti, použití a rizika cyklopropanu (C3H6)

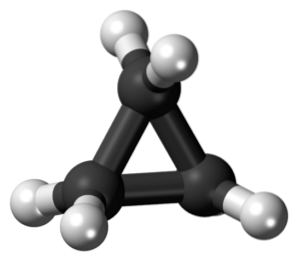
The cyklopropan je cyklická molekula, která má molekulární vzorec C3H6, a sestávající ze tří atomů uhlíku spojených dohromady ve formě kruhu. V chemii existuje rodina nasycených uhlovodíků, které mají kostru tvořenou atomy uhlíku spojenou jednoduchými vazbami ve formě kruhu..
Tato rodina se skládá z různého počtu molekul (které se liší délkou jejich hlavního uhlíkového řetězce) a je známo, že mají vyšší teploty tání a teploty varu než ty s vysokými řetězci a také vyšší reaktivitu než tyto..
Cyklopropan byl objeven v roce 1881 rakouským chemikem jménem August Freund, který byl odhodlán vědět, co je to toxický prvek v ethylenu a kdo si začal myslet, že se jedná o stejný cyklopropan.
Přesto se až třicátá léta začala vyrábět na průmyslové úrovni, když objevili její použití jako anestézie, protože do té doby pro ni nenašli komerční přitažlivost..
Rejstřík článků
- 1 Chemická struktura
- 2 Vlastnosti
- 2.1 Bod varu
- 2.2 Teplota tání
- 2.3 Hustota
- 2.4 Reaktivita
- 3 použití
- 4 Rizika
- 5 Reference
Chemická struktura
Cyklopropan, molekulárního vzorce C.3H6, Skládá se ze tří malých atomů uhlíku, které se spojují v konfiguraci tak, že se vytvoří kruh a zanechává molekulární symetrii D3h na každém uhlíku v řetězci.
Struktura této molekuly vyžaduje, aby vytvořené úhly vazby byly přibližně 60 °, mnohem menší než 109,5 °, které jsou pozorovány mezi sp hybridními atomy.3, což je termodynamicky stabilnější úhel.
To vede k tomu, že prsten trpí podstatnějším strukturálním napětím než jiné struktury tohoto typu, navíc k přirozenému torznímu napětí, které má díky zatmění konformaci atomů vodíku..
Ze stejného důvodu jsou vazby, které se tvoří mezi atomy uhlíku v této molekule, podstatně slabší než u běžných alkanů..
Zvláštním způsobem a na rozdíl od jiných vazeb, kde blízkost mezi dvěma molekulami symbolizuje větší energii vazby, mají vazby mezi uhlíky této molekuly tu zvláštnost, že mají kratší délku než ostatní alkany (kvůli jejich geometrii) a zároveň časem jsou slabší než odbory mezi nimi.
Cyklopropan má dále stabilitu cyklickou delokalizací šesti elektronů ve vazbách uhlík-uhlík, je o něco nestabilnější než cyklobutan a podstatně více než cyklohexan..
Vlastnosti
Bod varu
Ve srovnání s jinými běžnějšími cykloalkany má cyklopropan nejnižší bod varu mezi těmito typy molekul, voltatilizuje při 33 stupních pod nulou (žádné jiné cykloalkany těkají při teplotách pod nulou).
Na druhou stranu má cyklopropan ve srovnání s lineárním propanem vyšší teplotu varu: těkavý při teplotě 42 ° C pod nulou, o něco nižší než jeho cykloalkanový bratranec.
Bod tání
Bod tání cyklopropanu je nižší než bod tání jiných cykloalkanů, taje při teplotě 128 ° C nižší než nula. Přesto to není jediný cykloalkan, který taje při teplotě pod nulou, a tento jev lze pozorovat také u cyklobutanu, cyklopentanu a cykloheptanu..
Takže v případě lineárního propanu taje při teplotě nižší než 187 ° C pod nulou..
Hustota
Cyklopropan má nejvyšší hustotu mezi cykloalkany, je více než dvakrát vyšší než nejhustší běžný cykloalkan (1,879 g / l pro cyklopropan, překonávající cyklodecane s 0,871).
Vyšší hustota je také pozorována u cyklopropanu než u lineárního propanu. Rozdíl v bodech varu a tání mezi lineárními alkany a cykloalkany je způsoben vyššími londýnskými silami, které jsou zvýšeny tvarem prstence, který umožňuje větší kontaktní plochu mezi vnitřními atomy..
Reaktivita
Reaktivita molekuly cyklopropanu je přímo ovlivněna slabostí jejích vazeb, která se ve srovnání s jinými cykloalkany značně zvyšuje v důsledku působení napětí vyvíjeného na tyto vazby..
Díky tomu lze cyklopropan snadněji oddělit a při určitých reakcích se může chovat jako alken. Ve skutečnosti se extrémní reaktivita směsí cyklopropan-kyslík může stát nebezpečím výbuchu..
Aplikace
Komerční použití cyklopropanu par excellence je jako anestetikum, které tuto vlastnost studuje poprvé v roce 1929..
Cyklopropan je silné, rychle působící anestetikum, které nedráždí dýchací cesty ani nemá špatný zápach. Používal se několik desetiletí společně s kyslíkem k uspávání pacientů během operace, ale začaly být pozorovány nežádoucí vedlejší účinky, představované jako „cyklopropanový šok“..
Spolu s náklady a faktory vysoké hořlavosti prošel procesem vyřazení a nahrazení jinými bezpečnějšími anestetiky..
Přestože i nadále byla součástí sloučenin používaných při indukci anestézie, dnes není součástí látek používaných v lékařských aplikacích.
Rizika
- Cyklopropan je vysoce hořlavý plyn, který při styku s plamenem produkuje toxické plyny. Kromě toho může reagovat s oxidačními činidly, jako jsou chloristany, peroxidy, manganistany, dusičnany a halogeny, což způsobuje požáry a / nebo výbuchy..
- Vysoká hladina cyklopropanu může způsobit bolesti hlavy, závratě, nevolnost, ztrátu koordinace, pocit na omdlení a / nebo závratě..
- Může také vést k nepravidelnostem nebo arytmii srdečního rytmu, dýchacím potížím, kómatu nebo dokonce smrti..
- Zkapalněný cyklopropan může na pokožce způsobit omrzliny díky své teplotě výrazně pod nulou.
- Protože se jedná o plyn za okolních podmínek, může tato sloučenina snadno vstupovat do těla vzduchem a také snižuje hladinu kyslíku ve vzduchu..
Reference
- Britannica, E. (s.f.). Cyklopropan. Obnoveno z britannica.com
- Chemistry, O. (s.f.). Syntéza cyklopropanu. Obnoveno z organic-chemistry.org
- ChemSpider. (s.f.). Cyklopropan. Obnoveno z chemspider.com
- Wagnières, O. (s.f.). Přírodní produkty obsahující cyklopropan. Obnoveno z lspn.epfl.ch
- Wikipedia. (s.f.). Cyklopropan. Citováno z en.wikipedia.org


Zatím žádné komentáře