
Struktura hydroxidu amonného, vlastnosti a použití
The hydroxid amonný je sloučenina s molekulárním vzorcem NH4OH oh5NO vznikající rozpouštěním plynného amoniaku (NH3) ve vodě. Z tohoto důvodu se tomu říká čpavková voda nebo kapalný amoniak..
Je to bezbarvá kapalina s velmi intenzivním a ostrým zápachem, který není izolovatelný. Tyto vlastnosti mají přímý vztah s koncentrací NH3 rozpuštěný ve vodě; koncentrace, která ve skutečnosti může být plynem, může zahrnovat jeho obrovské množství rozpuštěné v malém objemu vody.
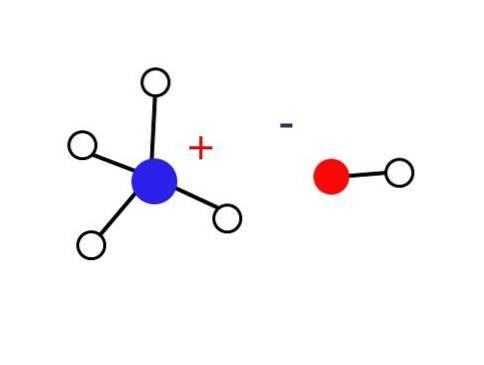
Značně malou část těchto vodných roztoků tvoří NH kationty.4+ a OH anionty-. Na druhé straně ve velmi zředěných roztocích nebo ve zmrazených pevných látkách při velmi nízkých teplotách lze amoniak nalézt ve formě hydrátů, jako jsou: NH3∙ HdvaNebo 2NH3∙ HdvaO a NH3∙ 2HdvaNEBO.
Zajímavostí je, že Jupiterovy mraky jsou tvořeny zředěnými roztoky hydroxidu amonného. Avšak vesmírné sondě Galileo se nepodařilo najít vodu v oblacích planety, což by se dalo očekávat kvůli znalostem, které máme o tvorbě hydroxidu amonného; to znamená, že jsou to NH krystaly4OH zcela bezvodý.
Amonný iont (NH4+) je produkován v renálním tubulárním lumenu spojením amoniaku a vodíku, vylučovaného renálními tubulárními buňkami. Obdobně je amoniak produkován v ledvinných tubulárních buňkách v procesu transformace glutaminu na glutamát a naopak při přeměně glutamátu na α-ketoglutarát.
Amoniak se průmyslově vyrábí metodou Haber-Bosch, při které se reagují plyny dusíku a vodíku; za použití katalyzátoru železitý iont, oxid hlinitý a oxid draselný. Reakce se provádí při vysokých tlacích (150 - 300 atmosfér) a vysokých teplotách (400 - 500 ° C) s výtěžkem 10 - 20%.
Při reakci se vyrábí amoniak, který při oxidaci produkuje dusitany a dusičnany. Ty jsou nezbytné při získávání kyseliny dusičné a hnojiv, jako je dusičnan amonný..
Rejstřík článků
- 1 Chemická struktura
- 1.1 Led amoniaku
- 2 Fyzikální a chemické vlastnosti
- 2.1 Molekulární vzorec
- 2.2 Molekulová hmotnost
- 2.3 Vzhled
- 2.4 Koncentrace
- 2.5 Zápach
- 2.6 Příchuť
- 2.7 Prahová hodnota
- 2.8 Bod varu
- 2.9 Rozpustnost
- 2.10 Rozpustnost ve vodě
- 2.11 Hustota
- 2.12 Hustota par
- 2.13 Tlak par
- 2.14 Korozivní působení
- 2,15 pH
- 2.16 Disociační konstanta
- 3 Názvosloví
- 4 Rozpustnost
- 5 Rizika
- 5.1 Reaktivita
- 6 použití
- 6.1 V potravinách
- 6.2 Terapeutika
- 6.3 Průmyslové a různé
- 6.4 V zemědělství
- 7 Reference
Chemická struktura
Jak naznačuje jeho definice, hydroxid amonný sestává z vodného roztoku plynného amoniaku. V kapalině proto neexistuje žádná jiná definovaná struktura než náhodná struktura NH iontů.4+ a OH- solvatovaný molekulami vody.
Amonné a hydroxylové ionty jsou produkty rovnováhy hydrolýzy amoniaku, takže je běžné, že tato řešení mají pronikavý zápach:
NH3(g) + HdvaO (l) <=> NH4+(ac) + OH-(ac)
Podle chemické rovnice by vysoký pokles koncentrace vody posunul rovnováhu k tvorbě více amoniaku; to znamená, že při zahřívání hydroxidu amonného se uvolňují páry amoniaku.
Z tohoto důvodu NH ionty4+ a OH- nevytvoří krystal za suchozemských podmínek, což vede k pevné bázi NH4Ach neexistuj.
Uvedená pevná látka by měla být složena pouze z elektrostaticky interagujících iontů (jak je znázorněno na obrázku).
Amoniakový led
Avšak při teplotách hluboko pod 0 ° C a obklopených enormními tlaky, jako jsou ty, které převládají v jádrech ledových měsíců, amoniak a voda zamrzají. Přitom krystalizují do pevné směsi s různými stechiometrickými poměry, nejjednodušší je NH3∙ HdvaO: monohydrát amoniaku.
NH3∙ HdvaO a NH3∙ 2HdvaNebo jsou to čpavkový led, protože pevná látka sestává z krystalického uspořádání molekul vody a amoniaku spojených vodíkovými vazbami..
Vzhledem ke změně T a P podle výpočtových studií, které simulují všechny fyzikální proměnné a jejich účinky na tyto ledy, dochází k přechodu fáze NH.3∙ nHdvaNebo do NH fáze4Ach.
Proto pouze za těchto extrémních podmínek NH4OH může existovat jako produkt protonace v ledu mezi NH3 a H.dvaNEBO:
NH3(s) + HdvaVy) <=> NH4Oh s)
Všimněte si, že tentokrát jsou na rozdíl od hydrolýzy amoniaku zúčastněné druhy v pevné fázi. Čpavkový led, který se stává slaným bez uvolňování amoniaku.
Fyzikální a chemické vlastnosti
Molekulární vzorec
NH4OH oh5NE
Molekulární váha
35,046 g / mol
Vzhled
Je to bezbarvá kapalina.
Koncentrace
Až asi 30% (pro ionty NH4+ a OH-).
Zápach
Velmi silný a ostrý.
Chuť
Akr.
Prahová hodnota
34 ppm pro nespecifickou detekci.
Bod varu
38 ° C (25%).
Rozpustnost
Existuje pouze ve vodném roztoku.
Rozpustnost ve vodě
Mísitelný v neomezeném rozsahu.
Hustota
0,90 g / cm3 při 25 ° C.
Hustota par
Relativní ke vzduchu vzatému jako jednota: 0,6. To znamená, že je méně hustý než vzduch. Logicky se však uváděná hodnota týká amoniaku jako plynu, nikoli jeho vodných roztoků nebo NH4Ach.
Tlak páry
2160 mmHg při 25 ° C.
Žíravá akce
Je schopen rozpouštět zinek a měď.
pH
11,6 (1N roztok); 11,1 (roztok 0,1 N) a 10,6 (0,01 N roztok).
Disociační konstanta
pKb = 4,767; Kb = 1,71 x 10-5 při 20 ° C
pKb = 4,751; Kb = 1774 x 10-5 při 25 ° C.
Zvyšování teploty téměř nepostřehnutelně zvyšuje zásaditost hydroxidu amonného.
Nomenklatura
Jaké jsou běžné a oficiální názvy, které NH dostává?4ACH? Podle toho, co stanoví IUPAC, se jmenuje hydroxid amonný, protože obsahuje hydroxylový anion.
Amonium je díky svému náboji +1 monovalentní, takže podle Stock nomenklatury je pojmenován jako: hydroxid amonný (I).
Ačkoli použití termínu hydroxid amonný je technicky nesprávné, protože sloučenina není izolovatelná (alespoň ne na Zemi, jak je podrobně vysvětleno v první části).
Hydroxid amonný se také nazývá amoniak voda a kapalný amoniak..
Rozpustnost
NH4OH neexistuje jako sůl v suchozemských podmínkách, nelze odhadnout, jak je rozpustný v různých rozpouštědlech.
Očekává se však, že bude extrémně rozpustný ve vodě, protože jeho rozpuštěním by se uvolnilo enormní množství NH3. Teoreticky by to byl úžasný způsob skladování a přepravy amoniaku.
V jiných rozpouštědlech schopných přijímat vodíkové vazby, jako jsou alkoholy a aminy, lze očekávat, že bude v nich také velmi dobře rozpustný. Tady NH kation4+ je donor vodíkové vazby a OH- působí jako oba.
Příklady těchto interakcí s methanolem by byly: H3N+-H - OHCH3 a HO- - HOCH3 (OHCH3 znamená, že kyslík přijímá vodíkovou vazbu, ne že je methylová skupina vázána na H).
Rizika
-Při styku s očima způsobuje podráždění, které může vést k poškození očí..
-Je korozivní. Při kontaktu s pokožkou může proto způsobit podráždění a při vysokých koncentracích činidla způsobit popáleniny kůže. Opakovaný kontakt hydroxidu amonného s pokožkou může způsobit její suchost, svědění a zarudnutí (dermatitida)..
-Vdechnutí mlhy hydroxidu amonného může způsobit akutní podráždění dýchacích cest charakterizované udušením, kašlem nebo dušností. Dlouhodobé nebo opakované vystavení látce může mít za následek opakované bronchiální infekce. Inhalace hydroxidu amonného může také způsobit podráždění plic..
-Vystavení vysokým koncentracím hydroxidu amonného může představovat lékařskou pohotovost, protože může dojít k hromadění tekutin v plicích (plicní edém)..
-Koncentrace 25 ppm byla brána jako limit expozice v 8hodinové pracovní směně v prostředí, kde je pracovník vystaven škodlivému působení hydroxidu amonného.
Reaktivita
-Kromě možného poškození zdraví při expozici hydroxidu amonnému existují při práci s látkou i další bezpečnostní opatření..
-Hydroxid amonný může reagovat s mnoha kovy, jako jsou: stříbro, měď, olovo a zinek. Rovněž reaguje se solemi těchto kovů za vzniku výbušných sloučenin a uvolňování plynného vodíku; který je zase hořlavý a výbušný.
-Může prudce reagovat se silnými kyselinami, například s kyselinou chlorovodíkovou, kyselinou sírovou a kyselinou dusičnou. Stejným způsobem také reaguje s dimethylsulfátem a halogeny..
-Reaguje se silnými zásadami, jako je hydroxid sodný a hydroxid draselný, za vzniku plynného amoniaku. To lze ověřit pozorováním rovnováhy v roztoku, ve kterém je přidání iontů OH- posouvá rovnováhu na tvorbu NH3.
-Při manipulaci s hydroxidem amonným by se neměly používat kovy mědi a hliníku ani jiné galvanizované kovy, protože na ně působí korozivně..
Aplikace
V jídle
-Používá se jako přísada do mnoha potravin, ve kterých působí jako kypřící prostředek, jako prostředek ke kontrole pH a jako povrchová úprava povrchu potravin..
-Seznam potravin, ve kterých se používá hydroxid amonný, je rozsáhlý a zahrnuje pečivo, sýry, čokolády, bonbóny a pudinky..
-Hydroxid amonný je podle FDA uveden jako bezpečná látka pro zpracování potravin, pokud jsou dodržovány stanovené standardy..
-V masných výrobcích se používá jako antimikrobiální látka, která je schopna eliminovat bakterie, jako je E. coli, a snížit ji na nedetekovatelnou úroveň. Bakterie se nacházejí ve střevech skotu a přizpůsobují se kyselému prostředí. Hydroxid amonný regulací pH brání růstu bakterií.
Terapeutika
-Hydroxid amonný má několik terapeutických použití, včetně:
-10% roztok se používá jako stimulant dýchacího reflexu
-Z vnějšku se používá na kůži k ošetření kousnutí a kousnutí hmyzem - Působí v zažívacím systému jako antacidum a karminativum, to znamená, že pomáhá eliminovat plyny.
Kromě toho se používá jako lokální léčivo pro akutní a chronické bolesti pohybového aparátu. V důsledku aktivního působení hydroxidu amonného dochází k lokálnímu zvýšení průtoku krve, zarudnutí a podráždění..
Průmyslové a různé
-Funguje na snížení NOx (vysoce reaktivní plyny, jako je oxid dusnatý (NO) a oxid dusičitý (NOdva)) pro emise z baterií a snížení emisí NOx ve svazcích.
-Používá se jako změkčovadlo; přísada do barvy a pro povrchovou úpravu.
-Zvyšuje pórovitost vlasů, což umožňuje pigmentům barviva větší penetraci, čímž se dosahuje lepší povrchové úpravy.
-Hydroxid amonný se používá jako antimikrobiální látka při čištění odpadních vod. Kromě toho se podílí na syntéze chloraminu. Tato látka plní při čištění vody v bazénu funkci podobnou chloru, má tu výhodu, že je méně toxická.
-Používá se jako inhibitor koroze v procesu rafinace ropy.
-Používá se jako čisticí prostředek v různých průmyslových a komerčních výrobcích a používá se na různé povrchy, včetně: nerezové oceli, porcelánu, skla a pece.
-Dále se používá při výrobě detergentů, mýdel, farmaceutik a inkoustů..
V zemědělství
I když se hydroxid amonný nepodává přímo jako hnojivo, plní tuto funkci. Amoniak se vyrábí z atmosférického dusíku metodou Haber-Bosch a přepravuje se v chladu pod jeho teplotou varu (-33 ° C) na místa jeho použití.
Stlačený amoniak se vstřikuje jako pára do půdy, kde okamžitě reaguje s edafickou vodou a přechází do formy amoniaku (NH4+), který je zadržován na kationtových výměnných místech půdy. Kromě toho se vyrábí hydroxid amonný. Tyto sloučeniny jsou zdrojem dusíku.
Spolu s fosforem a draslíkem tvoří dusík trojici hlavních rostlinných živin nezbytných pro jejich růst..
Reference
- Ganong, W. F. (2002). Lékařská fyziologie. 19. vydání. Moderní manuální redakce.
- A. D. Fortes, J. P. Brodholt, I. G. Wood a L. Vocadlo. (2001). Ab initio simulace monohydrátu amoniaku (NH3∙ HdvaO) a hydroxid amonný (NH4ACH). Americký fyzikální institut. J. Chem. Phys., Sv. 115, č. 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6. února 2017). Fakta o hydroxidu amonném. Obnoveno z: thoughtco.com
- Skupina Pochteca. (2015). Hydroxid amonný. pochteca.com.mx
- NJ zdraví. (s.f.). Informační list o nebezpečné látce: hydroxid amonný. [PDF]. Obnoveno z: nj.gov
- Chemistry Learner. (2018). Hydroxid amonný. Obnoveno z: chemistrylearner.com
- PubChem. (2018). Hydroxid amonný. Obnoveno z: pubchem.ncbi.nlm.nih.gov



Zatím žádné komentáře