
Chemická struktura kyseliny borité, vlastnosti, příprava, použití
The kyselina boritá je anorganická sloučenina, jejíž chemický vzorec je H3BO3. Skládá se z bílé nebo bezbarvé pevné látky. Je to slabá kyselina, která ve vodném roztoku produkuje v závislosti na své koncentraci pH mezi 3,8 a 4,8. Je špatně rozpustný ve studené vodě a mírně rozpustný v horké vodě..
Kyselinu boritou objevil v roce 1702 Wilhelm Homberg (1652-1713), který ošetřil borax kyselinou sírovou a získal tak léčivý roztok, který dostal název Hombergova sedativní voda..

Je však také poukázáno na to, že Homberg připravil kyselinu boritou přidáním vody k boraxu a zahříváním roztoku, dokud se neodpařil, takže krystaly kyseliny borité zůstaly v sedimentu..
Tato kyselina je velmi užitečná sloučenina, která má řadu aplikací v průmyslu a medicíně, používá se také jako insekticid, ochrana dřeva, zpomaluje hoření a je složkou pufrovacího roztoku pH..
Rejstřík článků
- 1 Chemická struktura
- 1.1 Krystaly
- 2 Vlastnosti
- 2.1 Jména
- 2.2 Molární hmotnost
- 2.3 Fyzický vzhled
- 2.4 Zápach
- 2.5 Příchuť
- 2.6 Teplota tání
- 2.7 Bod varu
- 2.8 Rozpustnost ve vodě
- 2.9 Rozpustnost v jiných rozpouštědlech
- 2,10 Rozdělovací koeficient oktanol / voda
- 2.11 Kyselost (pKa)
- 2,12 pH
- 2.13 Tlak par
- 2.14 Stabilita
- 2.15 Rozklad
- 2.16 Reaktivita
- 3 Příprava
- 4 použití
- 4.1 V průmyslu
- 4.2 V medicíně
- 4.3 Insekticid
- 4.4 Zachování
- 4,5 pH pufr
- 4.6 Jaderné reaktory
- 4.7 Zemědělství
- 5 Kontraindikace
- 6 Reference
Chemická struktura
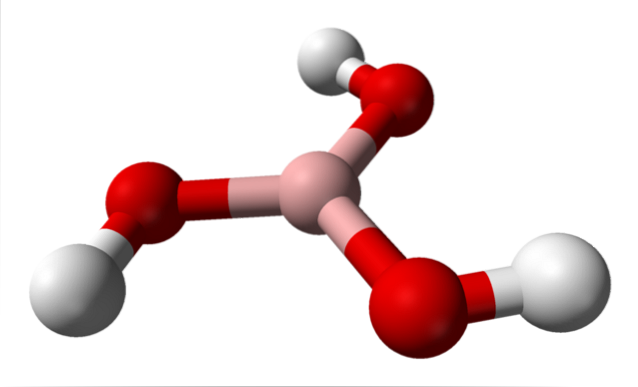
Na horním obrázku máme samotnou molekulu H3BO3. Všimněte si, že atomy vodíku, představované bílými koulemi, nejsou vázány na centrální atom boru, jak by mohl naznačovat chemický vzorec; ale spíše na atomy kyslíku, představované červenými koulemi.
Pohodlnějším, i když méně používaným vzorcem pro kyselinu boritou je tedy B (OH)3, což naznačuje, že jeho kyselost je způsobena ionty H+ propuštěni z jejich skupin OH. Molekula B (OH)3 má geometrii trigonální roviny, přičemž její atom boru má chemickou hybridizaci spdva.
B (OH)3 Jedná se o vysoce kovalentní molekulu, protože rozdíl elektronegativity mezi atomem boru a kyslíkem není příliš velký; takže vazby B-O jsou v podstatě kovalentní. Také si povšimněte, že struktura této molekuly se podobá struktuře rozmetače. Může se otáčet na vlastní ose stejným způsobem?
Krystaly
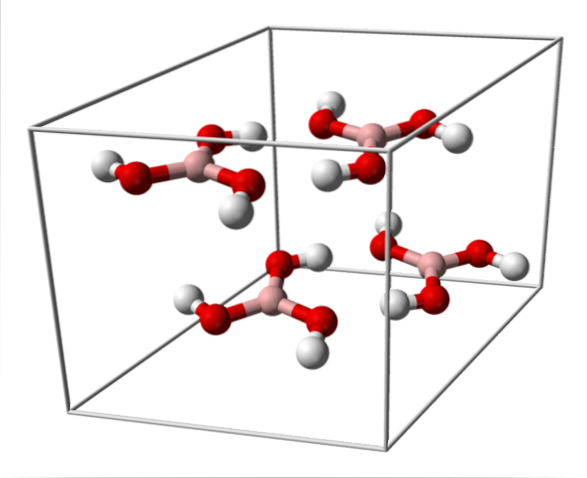
Horní obrázek ukazuje jednotkovou buňku odpovídající triclinické krystalové struktuře pro kyselinu boritou, která za určitých podmínek syntézy může přijmout kompaktní hexagonální strukturu. Všimněte si, že na jednotkovou buňku jsou čtyři molekuly a že jsou uspořádány ve dvou vrstvách, A a B, které se střídají (nejsou překrývající se jedna na druhou).
Vzhledem k symetrii a orientaci vazeb B-OH lze předpokládat, že B (OH)3 je nepolární; nicméně existence mezimolekulárních vodíkových vazeb mění příběh. Každá molekula B (OH)3 dávat nebo přijímat tři z těchto můstků s celkem šesti interakcemi dipól-dipól, jak je vidět na obrázku níže:
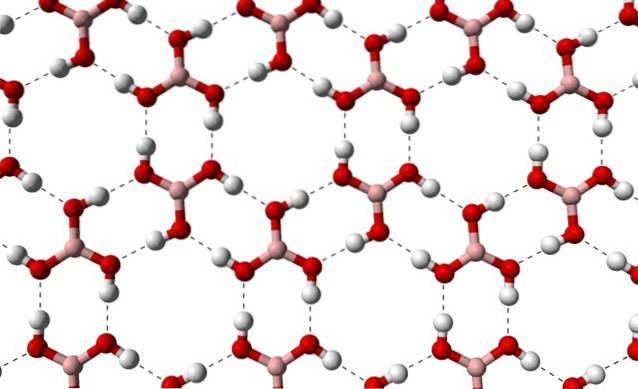
Všimněte si, že tyto vodíkové vazby jsou směrové interakce, které řídí krystaly kyseliny borité a vytvářejí vzory ornamentálních aspektů; vnitřní kroužky snad s dostatečným prostorem k uzavření nečistot, které nejsou v defektech krystalů.
Tyto vodíkové vazby navzdory nízké molekulové hmotnosti B (OH)3, udržují své sklo dostatečně soudržné, takže k roztavení potřebuje teplotu 171 ° C. Není známo, jaké účinky by měly vysoké tlaky (v řádu GPa) na molekulární vrstvy B (OH)3.
Vlastnosti
Jména
IUPAC: kyselina boritá a trihydrooxid boritý. Další názvy: kyselina orthoboritá, kyselina boritá, sassolit, borofax a trihydroxyboran.
Molární hmotnost
61,83 g / mol
Fyzický vzhled
Čirá, bezbarvá krystalická bílá pevná látka. Je také k dispozici ve formě granulí nebo jako bílý prášek. Na dotek mírně krémová.
Zápach
Toaleta
Chuť
Mírně hořké
Bod tání
170,9 ° C
Bod varu
300 ° C
Rozpustnost ve vodě
Středně rozpustný ve studené vodě a rozpustný v horké vodě:
2,52 g / 100 ml (0 ° C)
27,50 g / 100 ml (100 ° C)
Kyselina boritá je částečně rozpustná ve vodě a má tendenci se v ní potápět. Tato rozpustnost má tendenci se zvyšovat v přítomnosti kyselin, jako je kyselina chlorovodíková, citrónová a vinná..
Rozpustnost v jiných rozpouštědlech
-Glycerol: 17,5% při 25 ° C
-Ethylenglykol: 18,5% při 25 ° C
-Aceton: 0,6% při 25 ° C
-Ethylacetát: 1,5% při 25 ° C
-Metanol: 172 g / l při 25 ° C
-Ethanol: 94,4 g / l při 25 ° C
Rozdělovací koeficient oktanol / voda
Protokol P = -0,29
Kyselost (pKa)
9,24. 12.4. 13.3. Jedná se o tři konstanty jejich příslušných disociací k uvolnění H+ ve vodě.
pH
3,8 - 4,8 (3,3% ve vodném roztoku)
5,1 (0,1 molární)
Tlak páry
1,6 10-6 mmHg
Stabilita
Stabilní ve vodě
Rozklad
Rozkládá se při zahřátí nad 100 ° C za vzniku anhydridu kyseliny borité a vody.
Reaktivita
Kyselina boritá tvoří rozpustné soli s jednomocnými kationty, například: NadvaB4NEBO7.10HdvaO a nerozpustné soli s dvojmocnými kationty, CaB4NEBO7.6HdvaNEBO.
Ve vodném roztoku produkuje kyselý roztok v domnění, že tato vlastnost byla způsobena odečtením OH skupin- vody. Kyselina boritá je klasifikována jako slabá kyselina Lewisova typu.
Kyselina boritá reaguje s glycerolem a manitolem, čímž zvyšuje kyselost vodného prostředí. PKa je modifikována z 9,2 na 5 v důsledku tvorby chelátu boru a manitolu [BC6H8NEBOdva(ACH)dva]-, který uvolňuje H+.
Příprava
Kyselina boritá se nachází ve volném stavu ve vulkanických vyzařováních v oblastech, jako je Toskánsko v Itálii, Liparské ostrovy a ve státě Nevada v USA. To je také nalezené v minerálech, jako je borax, boracit, ulexit a colemanit..
Kyselina boritá se připravuje hlavně reakcí minerálního boraxu (dekahydrát tetraboritanu sodného) s minerálními kyselinami, jako je kyselina chlorovodíková, kyselina sírová atd..
NadvaB4NEBO910HdvaO + HCl => 4 H3BO3 + 2 NaCl + 5 HdvaNEBO
Připravuje se také hydrolýzou halogenidu boritého a diboranu..
Kyselina boritá se připravuje z colemanitu (CadvaB6NEBOjedenáct6 HdvaNEBO). Postup spočívá v úpravě minerálu kyselinou sírovou za účelem rozpuštění sloučenin boru.
Potom se roztok, ve kterém je přítomna kyselina boritá, oddělí od nerozpuštěných fragmentů. K roztoku se přidá sirovodík, aby se vysrážely nečistoty z arsenu a železa. Supernatant se ochladí za vzniku sraženiny kyseliny borité a oddělí ji od suspenze..
Aplikace
V průmyslu
Kyselina boritá se používá při výrobě skleněných vláken. Pomáhá snižovat bod tání a zvyšuje pevnost a účinnost textilních skleněných vláken: materiál používaný k vyztužení plastů používaných v lodích, průmyslových potrubích a deskách počítačových obvodů..
Kyselina boritá se podílí na výrobě borosilikátového skla, které umožňuje získání skla odolného vůči teplotním změnám, použitelného v kuchyni domácností, skleněného zboží v laboratořích, zářivek, optických vláken, LCD obrazovek atd..
Používá se v metalurgickém průmyslu k vytvrzování a ošetřování slitin oceli a také k podpoře kovového povlaku materiálů.
Používá se jako chemická složka při hydraulickém štěpení (frakování): metoda používaná při těžbě ropy a plynu. Kyselina boritá působí jako retardér hoření v celulózových, plastových a textilních materiálech, které jsou impregnovány kyselinou boritou pro zvýšení jejich odolnosti proti ohni..
V medicíně
Kyselina boritá se používá zředěná při výplachu očí. Želatinové kapsle z kyseliny borité se používají k léčbě plísňových infekcí, zejména Candida albicans. Používá se také při léčbě akné.
Kyselina boritá je pokropena ponožkami, aby se zabránilo infekcím nohou, například nohou sportovce. Podobně se roztoky obsahující kyselinu boritou používají při léčbě vnějšího otitis u lidí i zvířat..
Kyselina boritá se přidává do lahví používaných k odběru moči, což zabraňuje bakteriální kontaminaci před vyšetřením v diagnostických laboratořích..
Insekticid
Kyselina boritá se používá k potlačení šíření hmyzu, jako jsou švábi, termiti, mravenci atd. Nezabije okamžitě šváby, protože nejprve zničí jejich trávicí a nervový systém a zničí jejich exoskeleton.
Kyselina boritá působí pomalu, což umožňuje hmyzu, který ji požíval, přijít do styku s jiným hmyzem, čímž se šíří otrava..
Zachování
Kyselina boritá se používá k prevenci napadení dřeva houbami a hmyzem a používá se pro tento účel ve spojení s ethylenglykolem. Toto ošetření je také účinné při potírání bahna a řas..
PH pufr
Kyselina boritá a její konjugovaná báze tvoří pufrovací systém pKa = 9,24, což naznačuje, že tento pufr je nejúčinnější při alkalickém pH, což u živých bytostí není obvyklé. Boritanový pufr se však používá k regulaci pH v bazénech..
Jaderné reaktory
Kyselina boritá má schopnost zachytit tepelné neutrony, což snižuje možnost nekontrolovaného štěpení jader, které může vést k jaderným nehodám..
zemědělství
Bór je základním prvkem pro růst rostlin, což vedlo k použití kyseliny borité jako příspěvku prvku. Příliš mnoho kyseliny borité však může ublížit rostlinám, zejména citrusovým plodům..
Kontraindikace
Je třeba se vyvarovat použití kyseliny borité na obnaženou pokožku, rány nebo popáleniny, které umožňují její absorpci. Jedná se o toxickou sloučeninu uvnitř těla a v některých případech může způsobit mdloby, záchvaty, křeče, tiky obličeje a nízký krevní tlak..
O použití vaginálních tobolek kyseliny borité u těhotných žen by měl být konzultován lékař, protože bylo prokázáno, že by to mohlo způsobit deformace plodu a snížení tělesné hmotnosti dítěte při narození..
Rovněž je třeba se vyvarovat umístění kyseliny borité, používané jako insekticidu, na místa v dosahu dětí, protože děti mají větší náchylnost k toxickému působení kyseliny borité, protože v nich je smrtelná dávka stanovena na 2000 až 3000 mg.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Kyselina boritá. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Kyselina boritá. Databáze PubChem. CID = 7628. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Redaktoři Encyclopaedia Britannica. (28. března 2019). Kyselina boritá. Encyklopedie Britannica. Obnoveno z: britannica.com
- Vibrační nosič. (9. listopadu 2018). Skrytá použití kyseliny borité ve vašem každodenním životě. Obnoveno z: carriervibrating.com
- Národní informační centrum pro pesticidy. (s.f.). Kyselina boritá. Obnoveno z: npic.orst.edu
- Vypracování. (30. listopadu 2017). Kyselina boritá: vlastnosti a použití této chemické sloučeniny. Obnoveno z: acidos.info
- Chlorid sodný. (2019). Kyselina boritá. Obnoveno z: chlorurosodio.com
- Španělská společnost nemocniční farmacie. (s.f.). Kyselina boritá. [PDF]. Obnoveno z: workgroups.sefh.es



Zatím žádné komentáře