
Fyzikální a chemické vlastnosti kyseliny bromité (HBrO2) a použití

The kyselina bromitá Je to anorganická sloučenina vzorce HBrO2. Uvedená kyselina je jednou z oxokyselinových bromových kyselin, kde má oxidační stav 3+. Soli této sloučeniny jsou známé jako bromity. Je to nestabilní sloučenina, kterou nelze izolovat v laboratoři.
Tato nestabilita, analogická s kyselinou jodovou, je způsobena dismutační reakcí (nebo disproporcí) za vzniku kyseliny bromovodíkové a kyseliny bromovité následovně: 2HBrOdva → HBrO + HBrO3.
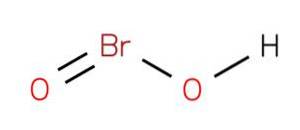
Kyselina bromitá může působit jako meziprodukt při různých reakcích při oxidaci hypobromitů (Ropp, 2013). Lze jej získat chemickými nebo elektrochemickými prostředky, kde se hypobromit oxiduje na iont bromitu, například:
HBrO + HClO → HBrOdva + HCl
HBrO + HdvaO + 2e- → HBrOdva + Hdva
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 použití
- 2.1 Sloučeniny alkalických zemin
- 2.2 Redukční činidlo
- 2.3 Belousov-Zhabotinski reakce
- 3 Odkazy
Fyzikální a chemické vlastnosti
Jak již bylo zmíněno výše, kyselina bromitá je nestabilní sloučenina, která nebyla izolována, takže její fyzikální a chemické vlastnosti jsou až na výjimky získány teoreticky výpočtovými výpočty (National Center for Biotechnology Information, 2017).
Sloučenina má molekulovou hmotnost 112,91 g / mol, teplotu tání 207,30 stupňů Celsia a teplotu varu 522,29 stupňů Celsia. Jeho rozpustnost ve vodě se odhaduje na 1 x 106 mg / l (Royal Society of Chemistry, 2015).
Při zacházení s touto sloučeninou neexistuje žádné registrované riziko, nicméně bylo zjištěno, že jde o slabou kyselinu..
Kinetika disproporcionační reakce bromu (III), 2Br (III) → Br (1) + Br (V), byla studována ve fosfátovém pufru, v rozmezí pH 5,9-8,0, sledování optické absorbance při 294 nm pomocí zastaveného tok.
Závislosti [H+] a [Br (III)] byly řádu 1, respektive 2, kde nebyla nalezena žádná závislost na [Br-]. Reakce byla také studována v acetátovém pufru v rozmezí pH 3,9 - 5,6.
V rámci experimentální chyby nebyl nalezen žádný důkaz pro přímou reakci mezi dvěma ionty BrO2. Tato studie poskytuje rychlostní konstanty 39,1 ± 2,6 M-1 pro reakci:
HBrOdva + BrOdva→ HOBr + Br03-
800 ± 100 M rychlostní konstanty-1 pro reakci:
2HBr0dva → HOBr + Br03- + H+
A rovnovážný kvocient 3,7 ± 0,9 X 10-4 pro reakci:
HBr02 ⇌ H + + BrOdva-
Získání experimentální pKa 3,43 při iontové síle 0,06 M a 25,0 ° C (R. B. Faria, 1994).
Aplikace
Sloučeniny alkalických zemin
Kyselina bromičitá nebo bromičnan sodný se používá k výrobě bromitanu berylnatého na základě reakce:
Být (OH)dva + HBrOdva → Buďte (OH) BrOdva + HdvaNEBO
Bromity mají žlutou barvu v pevném stavu nebo ve vodných roztocích. Tato sloučenina se průmyslově používá jako oxidační prostředek pro odstraňování vodního kamene při zušlechťování textilií (Egon Wiberg, 2001).
Redukční prostředek
Kyselinu bromičitou nebo bromitany lze použít ke snížení manganistanového iontu na manganičnan následujícím způsobem:
2MnO4- + BrOdva- + 2OH-→ BrO3- + 2MnO4dva- + HdvaNEBO
Co je vhodné pro přípravu roztoků manganu (IV).
Belousov-Zhabotinski reakce
Kyselina bromitá působí jako důležitý meziprodukt v reakci Belousov-Zhabotinski (Stanley, 2000), což je mimořádně vizuálně pozoruhodná demonstrace..
V této reakci se tři roztoky smísí a vytvoří zelenou barvu, která se změní na modrou, fialovou a červenou a poté se vrátí do zelené a opakuje se.
Tři řešení, která jsou smíšená, jsou následující: řešení KBrO3 0,23 M, 0,31 M roztok kyseliny malonové s 0,059 M KBr a 0,019 M roztok dusičnanu ceričitého amonného a HdvaSW4 2,7 mil.
Během prezentace se do roztoku zavede malé množství indikátorového ferroinu. Místo ceru lze použít manganové ionty. Celková B-Z reakce je cerem katalyzovaná oxidace kyseliny malonové bromičnanovými ionty ve zředěné kyselině sírové, jak je uvedeno v následující rovnici:
3CHdva (CO.)dvaH)dva + 4 BrO3- → 4 Br- + 9 COdva + 6 hdvaO (1)
Mechanismus této reakce zahrnuje dva procesy. Proces A zahrnuje ionty a přenosy dvou elektronů, zatímco proces B zahrnuje radikály a přenosy jednoho elektronu..
Koncentrace bromidových iontů určuje, který proces je dominantní. Proces A je dominantní, když je koncentrace bromidových iontů vysoká, zatímco proces B je dominantní, když je koncentrace bromidových iontů nízká..
Proces A je redukce bromičnanových iontů bromidovými ionty ve dvou elektronových přenosech. Může to být vyjádřeno touto čistou reakcí:
BrO3- + 5Br- + 6H+ → 3Brdva + 3HdvaNebo (2)
K tomu dochází při smíchání roztoků A a B. K tomuto procesu dochází prostřednictvím následujících tří kroků:
BrO3- + Br- +2 h+ → HBrOdva + HOBr (3)
HBrOdva + Br- + H+ → 2 HOBr (4)
HOBr + Br- +H+ → Brdva + HdvaNebo (5)
Brom vytvořený reakcí 5 reaguje s kyselinou malonovou, jak se pomalu enolizuje, což představuje následující rovnice:
Brdva + CHdva (CO.)dvaH)dva → BrCH (COdvaH)dva + Br- + H (6)
Tyto reakce snižují koncentraci bromidových iontů v roztoku. To umožňuje, aby se proces B stal dominantním. Celková reakce procesu B je představována následující rovnicí:
2BrO3- + 12H+ + 10 Ce3+ → Brdva + 10Ce4+6HdvaNEBO (7)
Skládá se z následujících kroků:
BrO3 - + HBrOdva + H+ → 2BrOdva • + HdvaNEBO (8)
BrOdva • + Ce3+ + H+ → HBrOdva + ES4+ (9)
2 HBrOdva → HOBr + BrO3 - + H+ (10)
2 HOBr → HBrOdva + Br- + H+ (jedenáct)
HOBr + Br- + H+ → Brdva + HdvaO (12)
Klíčové prvky této sekvence zahrnují čistý výsledek rovnice 8 plus dvakrát rovnice 9, jak je uvedeno níže:
2Ce3+ + BrO3 - + HBrOdva + 3H+ → 2Ce4+ + HdvaO + 2HBrOdva (13)
Tato sekvence produkuje kyselinu bromitou autokatalyticky. Autokatalýza je podstatným rysem této reakce, ale pokračuje až po vyčerpání reaktantů, protože dochází k destrukci HBrO2 druhého řádu, jak je vidět u reakce 10.
Reakce 11 a 12 představují disproporcionaci kyseliny bromovodíkové na kyselinu bromičitou a Br2. Ionty ceru a bromu oxidují kyselinu malonovou za vzniku bromidových iontů. To způsobí zvýšení koncentrace bromidových iontů, které reaktivuje proces A.
Barvy v této reakci vznikají hlavně oxidací a redukcí komplexů železa a ceru..
Ferroin poskytuje dvě barvy viděné v této reakci: Jak se [Ce (IV)] zvyšuje, oxiduje železo ve ferroinu z červeného železa (II) na modré železo (III). Cer (III) je bezbarvý a cer (IV) je žlutý. Kombinace ceru (IV) a železa (III) činí zelenou barvu.
Za správných podmínek se tento cyklus bude několikrát opakovat. Čistota skla je problémem, protože oscilace jsou přerušovány kontaminací chloridovými ionty (Horst Dieter Foersterling, 1993).
Reference
- kyselina bromitá. (2007, 28. října). Citováno z ChEBI: ebi.ac.uk.
- Egon Wiberg, N. W. (2001). Anorganická chemie. london-san diego: akademický tisk.
- Horst Dieter Foersterling, M. V. (1993). Kyselina bromitá / cer (4+): reakce a disproporcionace HBrO2 měřené v roztoku kyseliny sírové při různých kyselinách. Phys. Chem 97 (30), 7932-7938.
- kyselina jodičná. (2013-2016). Obnoveno z molbase.com.
- Národní centrum pro biotechnologické informace. (2017, 4. března). Složená databáze PubChem; CID = 165616.
- B. Faria, I. R. (1994). Kinetika disproporcionace a pKa kyseliny bromité. J. Phys. Chem. 98 (4), 1363-1367.
- Ropp, R. C. (2013). Encyklopedie sloučenin alkalické Země. Oxford: Elvesier.
- Royal Society of Chemistry. (2015). Kyselina bromitá. Obnoveno z chemspider.com.
- Stanley, A. A. (2000, 4. prosince). Pokročilá demonstrace anorganické chemie Souhrn oscilační reakce.


Zatím žádné komentáře