
Struktura kyseliny chromové, vlastnosti, výroba, použití

The kyselina chromová nebo HdvaCrO4 je to teoreticky kyselina spojená s oxidem chromitým nebo chromovým oxidem CrO3. Toto jméno je způsobeno skutečností, že druh HdvaCrO4 je přítomen spolu s dalšími druhy chromu (VI).
Oxid chromitý CrO3 také se jí říká bezvodá kyselina chromová. CrO3 je červenohnědá nebo fialová pevná látka, která se získá zpracováním roztoků dichromanu draselného KdvaCrdvaNEBO7 s kyselinou sírovou HdvaSW4.

Vodné roztoky oxidu chromitého vykazují rovnováhu určitých chemických látek, jejichž koncentrace závisí na pH roztoku. Při zásaditém pH převládají chromanové ionty CrO4dva-, zatímco při kyselém pH převládají ionty HCrO4- a Cr dichromandvaNEBO7dva-. Odhaduje se, že při kyselém pH je také přítomna kyselina chromová H.dvaCrO4.
Díky své velké oxidační síle se roztoky kyseliny chromové používají v organické chemii k provádění oxidačních reakcí. Používají se také v elektrochemických procesech k úpravě kovů způsobem, který je činí odolnými proti korozi a opotřebení..
Některé polymerní materiály jsou také ošetřeny kyselinou chromovou, aby se zlepšila jejich přilnavost ke kovům, barvám a dalším látkám..
Roztoky kyseliny chromové jsou vysoce nebezpečné pro člověka, většinu zvířat a životní prostředí. Z tohoto důvodu se kapalný nebo pevný odpad z procesů, při nichž se používá kyselina chromová, upravuje tak, aby se odstranily stopy chrómu (VI) nebo aby se znovu získal veškerý přítomný chrom a regenerovala se kyselina chromová k opětovnému použití..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Hustota
- 3.5 Rozpustnost
- 3.6 Další vlastnosti
- 4 Chemie vodných roztoků, kde je přítomna kyselina chromová
- 5 Získání
- 6 Použití kyseliny chromové
- 6.1 Při oxidaci chemických sloučenin
- 6.2 V procesech eloxování kovů
- 6.3 Při chemickém zpracování
- 6.4 Na erodovaných nebo důlkovitých površích
- 6.5 V různých použitích
- 7 Obnova kyseliny chromové
- 7.1 Použitím pryskyřic
- 7.2 Elektrochemickou regenerací
- 8 Použití mikroorganismů k čištění odpadních vod se stopami kyseliny chromové
- 9 Rizika kyseliny chromové a oxidu chromitého
- 10 Reference
Struktura
Molekula kyseliny chromové HdvaCrO4 je tvořen chromanovým iontem CrO4dva- a dva vodíkové ionty H+ k tomu připojené. V chromanovém iontu je prvek Chrom v oxidačním stavu +6.
Prostorová struktura chromanového iontu je čtyřboká, kde je chrom ve středu a kyslíky zabírají čtyři vrcholy čtyřstěnu..
V kyselině chromové jsou atomy vodíku každý společně s kyslíkem. Ze čtyř vazeb chrómu na atomy kyslíku jsou dvě dvojné a dvě jednoduché, protože k nim jsou připojeny vodíky.
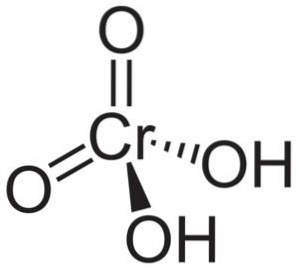
Na druhé straně oxid chromitý CrO3 má atom chrómu v oxidačním stavu +6 obklopený pouze třemi atomy kyslíku.
Nomenklatura
- Kyselina chromová HdvaCrO4
- Kyselina tetraoxochromová HdvaCrO4
- Oxid chromový (bezvodá kyselina chromová) CrO3
- Oxid chromitý (bezvodá kyselina chromová) CrO3
Vlastnosti
Fyzický stav
Bezvodá kyselina chromová nebo oxid chromový je fialová až červená krystalická pevná látka
Molekulární váha
CrO3: 118,01 g / mol
Bod tání
CrO3: 196 ° C
Nad teplotou tání je tepelně nestabilní, ztrácí kyslík (redukuje se) za vzniku oxidu chromitého (Cr)dvaNEBO3. Rozkládá se při přibližně 250 ° C.
Hustota
CrO3: 1,67 - 2,82 g / cm3
Rozpustnost
CrO3 je velmi rozpustný ve vodě: 169 g / 100 g vody při 25 ° C.
Je rozpustný v minerálních kyselinách, jako je kyselina sírová a dusičná. Rozpustný v alkoholu.
Další vlastnosti
CrO3 je velmi hygroskopický, jeho krystaly jsou rozplývavé.
Když CrO3 rozpouští se ve vodě a vytváří silně kyselé roztoky.
Je to velmi silný oxidant. Intenzivně oxiduje organickou hmotu téměř ve všech jejích formách. Útočí na látku, kůži a některé plasty. Také útočí na většinu kovů.
Je silně jedovatý a velmi dráždivý kvůli vysokému oxidačnímu potenciálu..
Chemie vodných roztoků, kde je přítomna kyselina chromová
Oxid chromitý CrO3 rychle se rozpouští ve vodě. Ve vodném roztoku může chrom (VI) existovat v různých iontových formách.
Při pH> 6,5 nebo v alkalickém roztoku získává chrom (VI) chromanový iont ve formě CrO4dva- žlutá.
Pokud je pH sníženo (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , který může dimerizovat na Cr dichromanový iondvaNEBO7dva-, a roztok se zbarví oranžově. Při pH mezi 2,5 a 5,5 převládajícími druhy jsou HCrO4- a ČRdvaNEBO7dva-.

Rovnováhy, které se v těchto roztocích vyskytují při snižování pH, jsou následující:
CrO4dva- (chromanový ion) + H+ ⇔ HCrO4-
HCrO4- + H+ ⇔ HdvaCrO4 (kyselina chromová)
2HCrO4- ⇔ CrdvaNEBO7dva- (dichromanový ion) + HdvaNEBO
K těmto rovnováhám dochází pouze v případě, že kyselinou přidanou ke snížení pH je HNO3 nebo HClO4, protože s jinými kyselinami se tvoří různé sloučeniny.
Roztoky kyselého dichromanu jsou velmi silná oxidační činidla. Ale v alkalických roztocích je chromanový ion mnohem méně oxidující.
Získávání
Podle konzultovaných zdrojů je jedním ze způsobů, jak získat oxid chromitý CrO3, To spočívá v přidání kyseliny sírové do vodného roztoku dichromanu sodného nebo draselného za vzniku červenooranžové sraženiny..

Kyselina chromová HdvaCrO4 Nachází se ve vodných roztocích oxidu chromitého v kyselém prostředí.
Kyselina chromová používá
Při oxidaci chemických sloučenin
Díky své silně oxidační schopnosti se kyselina chromová již dlouho úspěšně používá k oxidaci organických a anorganických sloučenin..
Mezi nesčetné příklady patří následující: umožňuje oxidovat primární alkoholy na aldehydy a ty na karboxylové kyseliny, sekundární alkoholy na ketony, toluen na kyselinu benzoovou, ethylbenzen na acetofenon, trifenylmethan na trifenylkarbinol, kyselinu mravenčí na COdva, kyselina šťavelová na COdva, kyselina mléčná na acetaldehyd a COdva, železný ion Fedva+ na železitý ion Fe3+, iont jodidu na jód atd.
Umožňuje přeměnu nitrososloučenin na nitrosloučeniny, sulfidy na sulfony. Podílí se na syntéze ketonů počínaje od alkenů, protože oxiduje hydroborované alkeny na ketony.
Sloučeniny vysoce odolné vůči běžným oxidantům, jako je kyslík Odva nebo peroxid vodíku HdvaNEBOdva, jsou oxidovány kyselinou chromovou. To je případ určitých heterocyklických boranů.
V procesech eloxování kovů
Anodizace kyselinou chromovou je elektrochemické zpracování aplikované na hliník, které jej po mnoho let chrání před oxidací, korozí a opotřebením..
Proces eloxování zahrnuje elektrochemickou tvorbu vrstvy oxidu hlinitého nebo oxidu hlinitého na kovu. Tato vrstva se poté uzavře v horké vodě, čímž se dosáhne přeměny na trihydrát oxidu hlinitého..
Utěsněná vrstva oxidu je silná, ale strukturálně slabá a není příliš uspokojivá pro následné lepení. Přidáním malého množství kyseliny chromové do těsnící vody se však vytvoří povrch, který může vytvářet dobré vazby..
Kyselina chromová v těsnící vodě rozpouští část hrubé buněčné struktury a zanechává tenkou, silnou a pevně připojenou vrstvu oxidu hlinitého, ke které lepidla přilnou a vytvářejí silné a trvanlivé vazby..
Anodizace chromovou kyselinou se vztahuje také na titan a jeho slitiny.
Při chemickém zpracování
Kyselina chromová se používá v procesech potahování kovů chemickou přeměnou.
Během tohoto procesu se kovy ponoří do roztoků kyseliny chromové. To reaguje a částečně rozpouští povrch, zatímco se ukládá tenká vrstva komplexních sloučenin chrómu, které interagují s obecným kovem..
Tento proces se nazývá chromátový konverzní povlak nebo konverzní chromování..
Kovy, které jsou obecně vystaveny chromování, jsou různé druhy oceli, jako je uhlíková ocel, nerezová ocel a pozinkovaná ocel, a různé neželezné kovy, jako jsou slitiny hořčíku, slitiny cínu, slitiny hliníku, měď. , kadmium, mangan a stříbro.
Tato úprava poskytuje kovům odolnost proti korozi a lesk. Čím vyšší je pH procesu, tím vyšší je odolnost proti korozi. Teplota urychluje kyselou reakci.
Lze použít různé barvy, jako je modrá, černá, zlatá, žlutá a čirá. Poskytuje také lepší přilnavost kovového povrchu k barvám a lepidlům.
Na erodovaných nebo důlkovitých površích
Roztoky kyseliny chromové se používají při přípravě povrchu předmětů z termoplastického materiálu, termosetových polymerů a elastomerů pro jejich následné potahování barvami nebo lepidly..
HdvaCrO4 má vliv na chemii povrchu a jeho strukturu, protože pomáhá zvýšit jeho drsnost. Kombinace důlkové koroze a oxidace zvyšuje penetraci lepidel a může dokonce způsobit změny ve vlastnostech polymeru..
Používá se k erozi rozvětveného polyethylenu s nízkou hustotou, lineárního polyetylenu s vysokou hustotou a polypropylenu.
Je široce používán v galvanickém nebo galvanickém průmyslu pro usnadnění adheze kov-polymer.
V různých použitích
Kyselina chromová se používá jako konzervační prostředek na dřevo, také v magnetických materiálech a pro katalýzu chemických reakcí.
Obnova kyseliny chromové
Existuje mnoho procesů, které používají kyselinu chromovou a vytvářejí proudy nebo zbytky obsahující chrom (III), kterých se nelze zbavit, protože mají vysoce toxické ionty chromu (VI), ani je nelze znovu použít, protože koncentrace chromanových iontů je velmi vysoká nízký..
Jejich likvidace vyžaduje chemickou redukci chromanu na chrom (III), následovanou srážením hydroxidu a filtrací, což generuje další náklady.
Z tohoto důvodu byly studovány různé metody odstraňování a regenerace chromátů. Zde jsou některé z nich.
Použitím pryskyřic
Iontoměničové pryskyřice se již mnoho let používají k úpravě vody kontaminované chromany. Toto je jedno z ošetření schválených americkou agenturou pro ochranu životního prostředí (EPA). Agentura na ochranu životního prostředí).
Tato metoda umožňuje získání koncentrované kyseliny chromové, protože se znovu regeneruje z pryskyřice..
Pryskyřice mohou být silné nebo slabé. Ve silně bazických pryskyřicích lze chromát odstranit díky iontům HCrO4- a ČRdvaNEBO7dva- jsou vyměňovány s OH ionty- a Cl-. Ve slabě bazických pryskyřicích, například síranových pryskyřicích, dochází k výměně iontů s SO4dva-.
V případě silně bazických R- (OH) pryskyřic jsou celkové reakce následující:
2ROH + HCrO4- + H+ ⇔ R.dvaCrO4 + 2HdvaNEBO
RdvaCrO4 + 2HCrO4- ⇔ 2RHCrO4 + CrO4dva-
RdvaCrO4 + HCrO4- + H+ ⇔ R.dvaCrdvaNEBO7 + HdvaNEBO
Pro každý mol RdvaCrO4 po převedení se z roztoku odstraní jeden mol Cr (VI), což činí tuto metodu velmi atraktivní..
Po odstranění chromátů se pryskyřice zpracuje silně zásaditým roztokem, aby se regenerovaly na bezpečném místě. Poté se chromáty převedou na koncentrovanou kyselinu chromovou, aby se mohly znovu použít..
Elektrochemickou regenerací
Další metodou je elektrochemická regenerace kyseliny chromové, která je také velmi pohodlnou alternativou. Tímto způsobem se chrom (III) anodicky oxiduje na chrom (VI). Anodovým materiálem je v těchto případech výhodně oxid olovnatý..
Použití mikroorganismů k čištění odpadních vod se stopami kyseliny chromové
Metoda, která byla zkoumána a stále je studována, je použití mikroorganismů přirozeně se vyskytujících v určitých odpadních vodách kontaminovaných šestimocnými ionty chrómu, které jsou obsaženy v roztocích kyseliny chromové..

To je případ určitých bakterií přítomných v odpadních vodách na činění kůže. Tyto mikroby byly studovány a bylo zjištěno, že jsou odolné vůči chromanům a jsou také schopné redukovat chrom (VI) na chrom (III), který je mnohem méně škodlivý pro životní prostředí a živé bytosti..
Z tohoto důvodu se odhaduje, že je lze použít jako ekologickou metodu pro sanaci a detoxikaci odpadních vod kontaminovaných stopami kyseliny chromové..
Kyselina chromová a oxid chromitý
CrO3 Není hořlavý, ale může zesílit spalování jiných látek. Mnoho z jejich reakcí může způsobit požár nebo výbuch.
CrO3 a roztoky kyseliny chromové jsou silnými dráždidly pro kůži (mohou způsobit dermatitidu), oči (mohou hořet) a sliznice (mohou způsobit bronchoasma) a mohou způsobit tzv. „chromové díry“ v dýchacím systému.
Sloučeniny chromu, jako je kyselina chromová a oxid chromový, jsou pro většinu živých organismů vysoce toxické, mutagenní a karcinogenní..
Reference
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- NÁS. Národní lékařská knihovna. (2019). Kyselina chromová. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. a Van Twisk, J. (2013). Hliník a slitiny hliníku. 2.5. Proces anodizace kyseliny chromové. In Techniky přípravy povrchu pro lepení (druhé vydání). Obnoveno ze sciencedirect.com.
- Wegman, R.F. a Van Twisk, J. (2013). Hořčík. 6.4. Příprava hořčíku a slitin hořčíku procesy zpracování kyselinou chromovou. In Techniky přípravy povrchu pro lepení (druhé vydání). Obnoveno ze sciencedirect.com.
- Grot, W. (2011). Aplikace. 5.1.8. Regenerace kyseliny chromové. In Fluorinated Ionomers (Second Edition). Obnoveno ze sciencedirect.com.
- Swift, K.G. a Booker, J.D. (2013). Procesy povrchového inženýrství. 9.7. Chromování. V příručce pro výběr výrobního procesu. Obnoveno ze sciencedirect.com.
- Poulsson, A.H.C. et al. (2019). Techniky povrchové úpravy PEEK, včetně plazmové povrchové úpravy. 11.3.2.1. Leptání povrchu. V příručce PEEK Biomaterials Handbook (druhé vydání). Obnoveno ze sciencedirect.com.
- Westheimer, F.H. (1949). Mechanismy oxidace kyseliny chromové. Chemické recenze 1949, 45, 3, 419-451. Obnoveno z pubs.acs.org.
- Tan, H.K.S. (1999). Odstranění kyseliny chromové pomocí aniontové burzy. Canadian Journal of Chemical Engineering, svazek 77, únor 1999. Obnoveno z onlinelibrary.wiley.com.
- Kabir, M.M. et al. (2018). Izolace a charakterizace bakterií snižujících chrom (VI) z odpadních vod a pevných odpadů. World Journal of Microbiology and Biotechnology (2018) 34: 126. Obnoveno z ncbi.nlm.nih.gov.


Zatím žádné komentáře