
Struktura kyseliny dusité (HNO2), vlastnosti, syntéza

The kyselina dusitá je slabá anorganická kyselina, jejíž chemický vzorec je HNOdva. Nachází se hlavně ve vodném roztoku bledě modré barvy. Je velmi nestabilní a rychle se rozkládá na oxid dusnatý, NO a kyselinu dusičnou, HNO3.
Obvykle se nachází ve vodném roztoku ve formě dusitanů. Přirozeně také pochází z atmosféry v důsledku reakce oxidu dusnatého s vodou. Tam, konkrétně v troposféře, kyselina dusitá zasahuje do regulace koncentrace ozonu.

Na obrázku výše je znázorněno řešení HNOdva kde je oceněna charakteristická bledě modrá barva této kyseliny. Syntetizuje se rozpuštěním oxidu dusnatého, NdvaNEBO3, ve vodě. Podobně je to produkt okyselení roztoků dusitanu sodného při nízkých teplotách..
HNOdva Má malé komerční využití, používá se ve formě dusitanu při konzervování masa. Na druhou stranu se používá při výrobě azobarviv.
Používá se ve spojení s thiosíranem sodným při léčbě pacientů s otravou kyanidem sodným. Jedná se však o mutagenní látku a předpokládá se, že může způsobit substituce v základech řetězců DNA prostřednictvím oxidační deaminace cytosinu a adeninu..
Kyselina dusitá má dvojí chování, protože se může chovat jako oxidační činidlo nebo jako redukční činidlo; to znamená, že může být snížen na NO nebo Ndva, u oxidujete na HNO3.
Rejstřík článků
- 1 Struktura kyseliny dusité
- 2 Vlastnosti
- 2.1 Chemické názvy
- 2.2 Fyzický popis
- 2.3 Molekulová hmotnost
- 2.4 Disociační konstanta
- 2.5 Teplota tání
- 2.6 Bod varu
- 2.7 Tvorba soli
- 2.8 Požární potenciál
- 2.9 Rozklad
- 2.10 Redukční činidlo
- 2.11 Oxidační činidlo
- 3 Názvosloví
- 4 Syntéza
- 5 Rizika
- 6 použití
- 6.1 Výroba diazoniových solí
- 6.2 Odstranění azidu sodného
- 6.3 Syntéza oximů
- 6.4 Ve své solné formě
- 7 Reference
Struktura kyseliny dusité
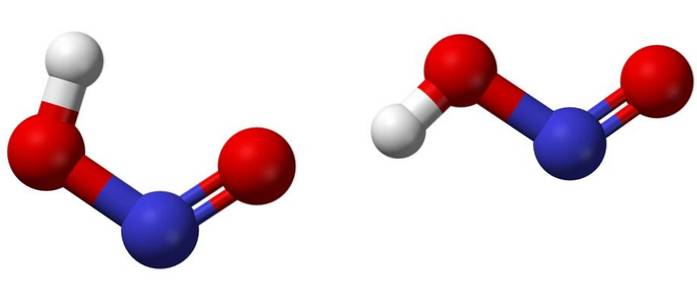
Horní obrázek ukazuje molekulární strukturu kyseliny dusité pomocí modelu koulí a tyčí. Atom dusíku (modrá koule) je umístěn ve středu struktury a tvoří dvojnou vazbu (N = O) a jednoduchou vazbu (N-O) s atomy kyslíku (červené koule).
Všimněte si, že atom vodíku (bílá koule) je navázán na jeden z kyslíků a ne přímo na dusík. S vědomím toho tedy strukturní vzorec HNOdva je [HO-N = O] nebo [NO (OH)] a neexistuje žádná taková vazba H-N (jak může naznačovat chemický vzorec).
Molekuly na obrázku odpovídají molekulám plynné fáze; ve vodě jsou obklopeni molekulami vody, které mohou přijmout slabě vodíkový iont za vzniku iontů NOdva- a H3NEBO+.
Jejich struktury mohou mít dvě formy: cis nebo trans, nazývané geometrické izomery. V cis izomeru je atom H zastíněn sousedním atomem kyslíku; zatímco v trans izomeru jsou oba v anti nebo opačných polohách.
V cis izomeru je pravděpodobné vytvoření intramolekulárního vodíkového můstku (OH-NO), který může narušit ty intermolekulární (ONOH-ONOH)..
Vlastnosti
Chemické názvy
-Kyselina dusitá
-Kyselina dioxonitrová (III)
-Nitrosyl hydroxid
-Hydroxid oxidonitrogen (systematický název IUPAC)
Fyzický popis
Bledě modrá kapalina, odpovídající roztoku dusitanu.
Molekulární váha
47,013 g / mol.
Disociační konstanta
Je to slabá kyselina. Jeho pKa je 3,35 při 25 ° C.
Bod tání
Je známo pouze v řešení. Nelze tedy vypočítat jeho teplotu tání ani izolovat jeho krystaly..
Bod varu
Protože neexistuje čistá, ale ve vodě, měření této vlastnosti nejsou přesná. Na jedné straně to závisí na koncentraci HNOdva, a na druhé straně jeho zahřívání způsobuje jeho rozklad. Proto se neuvádí přesný bod varu..
Tvorba solí
Vytváří ve vodě rozpustné dusitany s Li+, Na+, K.+, ACdva+, pandva+, Badva+. Netvoří však soli s vícemocnými kationty, jako například: Al3+ a / nebo býtdva+ (kvůli vysoké hustotě náboje). Je schopen tvořit stabilní estery s alkoholy.
Požární potenciál
Je hořlavý chemickými reakcemi. Při kontaktu s chloridem fosforečným může explodovat.
Rozklad
Je to velmi nestabilní sloučenina a ve vodném roztoku se rozkládá na oxid dusnatý a kyselinu dusičnou:
2 HNOdva => NEdva + NE + HdvaNEBO
4 HNOdva => 2 HNO3 + NdvaO + HdvaNEBO
Redukční prostředek
Kyselina dusitá ve vodném roztoku se vyskytuje ve formě dusitanových iontů, NOdva-, které podstupují různé redukční reakce.
Reaguje s ionty iontů- a víradva+, ve formě dusitanu draselného za vzniku oxidu dusnatého:
2 KNOdva + KI + HdvaSW4 => Jádva + 2 NO + 2 HdvaO + K.dvaSWdva
Dusitan draselný se v přítomnosti iontů cínu redukuje za vzniku oxidu dusného:
KNOdva + 6 HCl + 2 SnCldva => 2 SnCl4 + NdvaO + 3 HdvaO + 2 KCl
Dusitan draselný je redukován Zn v alkalickém prostředí za vzniku amoniaku:
5 hdvaO + KNOdva + 3 Zn => NH3 + KOH + 3 Zn (OH)dva
Oxidační činidlo
Kromě toho, že je kyselina dusitá redukčním činidlem, může zasahovat do oxidačních procesů. Například: oxiduje sirovodík a mění se na oxid dusnatý nebo amoniak v závislosti na kyselosti prostředí, ve kterém reakce probíhá.
2 HNOdva + HdvaS => S + 2NO + 2 HdvaNEBO
HNOdva + 3 HdvaS => S + NH3 + 2 hdvaNEBO
Kyselina dusitá v prostředí kyselého pH může oxidovat jodidový iont na jód.
HNOdva + Já- + 6 h+ => 3 Idva + NH3 + 2 hdvaNEBO
Může také působit jako redukční činidlo působením na Cudva+, což vede k tvorbě kyseliny dusičné.
Nomenklatura
HNOdva Mohou mu být přidělena další jména, která závisí na typu nomenklatury. Kyselina dusitá odpovídá tradiční nomenklatuře; kyselina dioxonitrová (III), do nomenklatury zásob; a hydrogen dioxonitrát (III) na systematické.
Syntéza
Kyselinu dusitou lze syntetizovat rozpuštěním oxidu dusnatého ve vodě:
NdvaNEBO3 + HdvaO => 2 HNOdva
Další způsob přípravy spočívá v reakci dusitanu sodného, NaNO3, s minerálními kyselinami; jako je kyselina chlorovodíková a kyselina bromovodíková. Reakce se provádí při nízké teplotě a kyselina dusitá se spotřebovává in situ..
Starší bratr3 + H+ => HNOdva + Na+
H iont+ pochází buď z HCl nebo HBr.
Rizika
Vzhledem k jeho vlastnostem a chemickým vlastnostem existuje jen málo informací o přímých toxických účincích HNO.dva. Možná, že některé škodlivé účinky, o nichž se předpokládá, že jsou produkovány touto sloučeninou, jsou ve skutečnosti způsobeny kyselinou dusičnou, která může být způsobena rozpadem kyseliny dusité..
Je třeba poznamenat, že HNOdva může mít škodlivé účinky na dýchací cesty a může u astmatických pacientů vyvolat dráždivé příznaky.
Ve formě dusitanu sodného je redukován deoxyhemoglobinem za vzniku oxidu dusnatého. Jedná se o silný vazodilatátor, který produkuje relaxaci hladkého svalstva cév, přičemž se odhaduje dávka LD50 35 mg / kg pro orální spotřebu u lidí..
Toxicita dusitanu sodného se projevuje kardiovaskulárním kolapsem, po kterém následuje silná hypotenze v důsledku vazodilatačního působení oxidu dusnatého produkovaného z dusitanu..
Oxid dusičitý, NOdva, přítomný ve znečištěném vzduchu (smog), za určitých podmínek může způsobit kyselinu dusitou; které zase mohou reagovat s aminy za vzniku nitrosaminů, gama karcinogenních sloučenin.
Podobná reakce nastává u cigaretového kouře. Bylo zjištěno, že zbytky nitrosaminu ulpívají na vnitřním obložení vozidel kuřáků.
Aplikace
Výroba diazoniových solí
Kyselina dusitá se v průmyslu používá při výrobě diazoniových solí reakcí s aromatickými aminy a fenoly.
HNOdva + ArNHdva + H+ => ArN = NAr + HdvaNEBO
Diazoniové soli se používají při reakcích organické syntézy; například v Sandmeyerově reakci. V této reakci je substituce aminoskupiny (HdvaN-), v primárním aromatickém aminu, Cl skupinami-, Br- a CN-. K získání těchto aromatických produktů jsou zapotřebí soli mědi.
Diazoniové soli mohou tvořit jasné azosloučeniny, které se používají jako barviva a slouží také jako kvalitativní test na přítomnost aromatických aminů..
Odstranění azidu sodného
Kyselina dusitá se používá k odstranění azidu sodného (NaN3), který je potenciálně nebezpečný z důvodu své tendence k výbuchu.
2 NaN3 + 2 HNOdva => 3 N.dva + 2 NO + 2 NaOH
Syntéza oximů
Kyselina dusitá může reagovat s ketonovými skupinami za vzniku oximů. Ty mohou být oxidovány za vzniku karboxylových kyselin nebo redukovány za vzniku aminů..
Tento proces se používá při komerční přípravě kyseliny adipové, monomeru používaného při výrobě nylonu. Podílí se také na výrobě polyurethanu a jeho estery jsou změkčovadla, zejména PVC.
Ve své solné formě
Kyselina dusitá ve formě dusitanu sodného se používá k ošetření a konzervování masa; protože zabraňuje růstu bakterií a je schopen reagovat s myoglobinem a vytváří tmavě červenou barvu, díky níž je maso atraktivnější pro konzumaci.
Tato stejná sůl se používá společně s thiosíranem sodným při intravenózní léčbě otravy kyanidem sodným..
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- PubChem. (2019). Kyselina dusitá. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Softschools. (2019). Kyselina dusitá. Obnoveno z: Softschools.com
- Wikipedia. (2019). Kyselina dusitá. Obnoveno z: en.wikipedia.org
- Royal Society of Chemistry. (2015). Kyselina dusitá. Obnoveno z: chemspider.com
- Encyklopedie nového světa. (2015). Kyselina dusitá. Obnoveno z: newworldencyclopedia.org
- DrugBank. (2019). Kyselina dusitá. Obnoveno z: drugbank.ca
- Chemická formulace. (2018). HNOdva. Obnoveno z: formulacionquimica.com


Zatím žádné komentáře