
Komponenty elektrochemických článků, jak fungují, typy, příklad
The elektrochemické články Jsou to zařízení, ve kterých probíhají chemické reakce, při nichž se chemická energie přeměňuje na elektrickou energii nebo naopak. Tyto buňky tvoří srdce elektrochemie, přičemž duše je potenciální výměnou elektronů, ke které může dojít, spontánně či nikoli, mezi dvěma chemickými druhy..
Jeden ze dvou druhů oxiduje, ztrácí elektrony, zatímco druhý se redukuje a získává přenesené elektrony. Obvykle je redukovaným druhem kovový kation v roztoku, který získáním elektronů končí elektrickým ukládáním na elektrodě vyrobené ze stejného kovu. Na druhou stranu druh, který oxiduje, je kov, který se mění na kovové kationty.
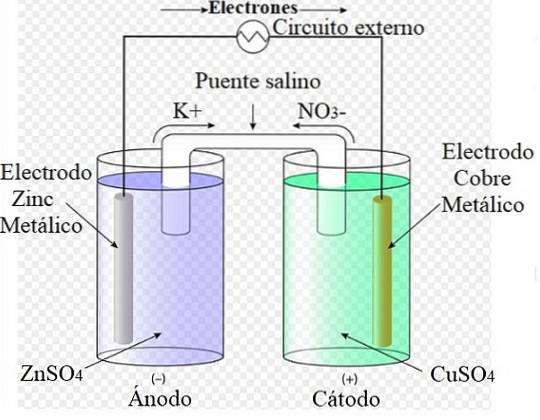
Například výše uvedený obrázek představuje Danielův článek: nejjednodušší ze všech elektrochemických článků. Kovová zinková elektroda oxiduje a uvolňuje Zn kationtydva+ do vodného média. K tomu dochází v kontejneru ZnSO4 nalevo.
Vpravo roztok obsahující CuSO4 se redukuje a transformuje kationty Cudva+ v kovové mědi, která je uložena na měděné elektrodě. Během vývoje této reakce procházejí elektrony vnějším obvodem aktivujícím jeho mechanismy; a proto poskytuje elektrickou energii pro provoz týmu.
Rejstřík článků
- 1 Součásti elektrochemických článků
- 1.1 Elektrody
- 1.2 Rozpouštění elektrolytů
- 1.3 Solný most
- 2 Typy elektrochemických článků a jejich fungování
- 2.1 Galvanické
- 2.2 Elektrolytika
- 3 příklady
- 3.1 Danielova cela
- 3.2 Platinový a vodíkový článek
- 3.3 Downsova buňka
- 4 Odkazy
Komponenty elektrochemických článků
Elektrody
Elektrické proudy se generují nebo spotřebovávají v elektrochemických článcích. Aby byl zajištěn adekvátní tok elektronů, musí existovat materiály, které jsou dobrými vodiči elektřiny. Zde přicházejí elektrody a vnější obvod, které jsou vybaveny měděným, stříbrným nebo zlatým vedením..
Elektrody jsou materiály, které poskytují povrch, kde budou reakce probíhat v elektrochemických článcích. Existují dva typy podle reakce, která v nich nastane:
-Anoda, elektroda, kde dochází k oxidaci
-Katoda, elektroda, kde dochází k redukci
Elektrody mohou být vyrobeny z reagujícího materiálu, jako v případě Danielova článku (zinek a měď); nebo inertní materiál, například když jsou vyrobeny z platiny nebo grafitu.
Elektrony uvolněné anodou musí dosáhnout katody; ale ne prostřednictvím řešení, ale prostřednictvím kovového kabelu, který spojuje obě elektrody s externím obvodem.
Rozpouštění elektrolytů
Důležitou roli hraje také řešení, které obklopuje elektrody, protože je obohaceno o silné elektrolyty; jako například: KCl, KNO3, NaCl atd. Tyto ionty upřednostňují do určité míry migraci elektronů z anody na katodu a také jejich vedení v blízkosti elektrod pro interakci s druhy, které mají být omezeny..
Například mořská voda vede elektřinu mnohem lépe než destilovaná voda s nižší koncentrací iontů. Proto mají elektrochemické články mezi složkami rozpuštěné silné elektrolyty..
Solný most
Ionty roztoku začnou obklopovat elektrody a způsobovat polarizaci nábojů. Roztok kolem katody začíná být negativně nabitý, protože kationty jsou redukovány; v případě Danielovy buňky kationty Cudva+ nanášením jako kovová měď na katodu. Začíná tedy existovat deficit kladných nábojů.
Zde zasahuje solný můstek, aby vyrovnal náboje a zabránil polarizaci elektrod. Směrem ke straně nebo komoře katody budou kationy migrovat ze solného můstku, buď K.+ nebo Zndva+, nahradit Cudva+ spotřebované. Mezitím nebudou ze solného můstku migrovat ŽÁDNÉ anionty3- směrem k anodovému oddělení, aby neutralizoval zvyšující se koncentraci kationů Zndva+.
Solný můstek se skládá z nasyceného roztoku solí, jehož konce jsou pokryty gelem, který je propustný pro ionty, ale nepropustný pro vodu..
Typy elektrochemických článků a jejich fungování
Jak elektrochemický článek funguje, závisí na tom, o jaký typ jde. V zásadě existují dva typy: galvanický (nebo galvanický) a elektrolytický.
Galvanické
Danielův článek je příkladem galvanického elektrochemického článku. V nich reakce probíhají spontánně a potenciál baterie je pozitivní; čím vyšší je potenciál, tím více elektřiny buňka dodá.
Články nebo baterie jsou přesně galvanické články: chemický potenciál mezi dvěma elektrodami se přemění na elektrickou energii, když do nich zasáhne vnější obvod, který je spojuje. Elektrony tedy migrují z anody, zapalují zařízení, ke kterému je připojena baterie, a jsou vráceny přímo do katody.
Elektrolytické
Elektrolytické články jsou ty, jejichž reakce nenastávají spontánně, pokud nejsou napájeny elektrickou energií z vnějšího zdroje. Zde dochází k opačnému jevu: elektřina umožňuje vývoj spontánních chemických reakcí.
Jednou z nejznámějších a nejcennějších reakcí, které v tomto typu článku probíhají, je elektrolýza..
Dobíjecí baterie jsou příklady elektrolytických a zároveň galvanických článků: jsou dobíjeny, aby zvrátily jejich chemické reakce a obnovily počáteční podmínky pro opětovné použití..
Příklady
Danielova cela
Následující chemická rovnice odpovídá reakci v Danielově článku, kde se účastní zinek a měď:
Zn (y) + Cudva+(aq) → Zndva+(aq) + Cu (y)
Ale kationty Cudva+ a Zndva+ nejsou sami, ale doprovázeni anionty SO4dva-. Tuto buňku lze reprezentovat takto:
Zn | ZnSO4 | | KURS4 | Cu
Danielova buňka může být postavena v jakékoli laboratoři, což je velmi opakující se praxe při zavádění elektrochemie. Jako Cudva+ je uložen jako Cu, modrá barva roztoku CuSO4 bude ztraceno.
Platinový vodíkový článek
Představte si buňku, která spotřebovává plynný vodík, vyrábí kovové stříbro a současně dodává elektřinu. Jedná se o platinový a vodíkový článek a jeho obecná reakce je následující:
2 Agg (s) + Hdva(g) → 2Ag (s) + 2H+ + 2Cl-
Tady v anodovém oddělení máme inertní platinovou elektrodu, ponořenou do vody a do které je čerpán plynný vodík. Hdva oxiduje na H+ a dává své elektrony mléčné sraženině AgCl v katodové komoře kovovou stříbrnou elektrodou. Na tomto stříbře se AgCl sníží a hmotnost elektrody se zvýší..
Tuto buňku lze reprezentovat jako:
Pt, Hdva | H+ | | Cl-, AgCl | Ag
Buňka Downs
A konečně, mezi elektrolytickými články máme roztavený článek chloridu sodného, lépe známý jako Downsův článek. Zde se používá elektřina, takže objem roztaveného NaCl prochází elektrodami, což v nich vyvolává následující reakce:
2Na+(l) + 2e- → 2Na (s) (katoda)
2Cl-(l) → Cldva(g) + 2e- (anoda)
2NaCl (l) → 2Na (s) + Cldva(g) (globální reakce)
Díky elektřině a chloridu sodnému lze tedy připravit plynný kovový sodík a chlor..
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2020). Elektrochemický článek. Obnoveno z: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (29. ledna 2020). Elektrochemické články. Obnoveno z: thoughtco.com
- R. Loď. (s.f.). Elektrochemické články. Obnoveno z: hyperphysics.phy-astr.gsu.edu
- Chemicool. (2017). Definice elektrochemického článku. Obnoveno z: chemicool.com
- Patricia Jankowski. (2020). Co je to elektrochemický článek? - Struktura a použití. Studie. Obnoveno z: study.com
- Alchymie (3. března 2011). Elektrochemické články. Chemie a věda. Obnoveno z: laquimicaylaciencia.blogspot.com



Zatím žádné komentáře