
Struktura sirovodíku (H2S), vlastnosti, použití, význam

The sirovodík nebo sirovodík je plyn tvořený spojením atomu síry (S) a dvou atomů vodíku (H). Jeho chemický vzorec je HdvaS. Také známý jako plynný sirovodík. Je to bezbarvý plyn, jehož vůně je patrná ve shnilých vejcích.
Je přítomen v sopkách a sirných horkých pramenech, v zemním plynu a v ropě. Vzniká také během anaerobního rozkladu (bez kyslíku) rostlinných a živočišných organických látek. Přirozeně se vyskytuje v těle savců působením určitých enzymů na cystein, neesenciální aminokyselinu.
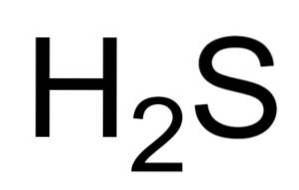
Vodné roztoky HdvaS jsou korozivní pro kovy, jako je ocel. HdvaS je redukční sloučenina, která při reakci s SOdva , oxiduje na elementární síru a redukuje na SOdva také síra.
Přestože se jedná o vysoce toxickou a smrtelnou sloučeninu pro člověka a zvířata, její význam v řadě důležitých procesů v těle byl již několik let studován..
Reguluje řadu mechanismů souvisejících s tvorbou nových krevních cév a fungováním srdce.
Chrání neurony a předpokládá se, že působí proti chorobám, jako je Parkinsonova choroba a Alzheimerova choroba.
Díky své chemické redukční schopnosti může bojovat proti oxidačním druhům, a tím působit proti stárnutí buněk. Z těchto důvodů je studována možnost výroby léků, které se při podávání pacientům mohou pomalu uvolňovat do těla..
To by sloužilo k léčbě patologických stavů, jako je ischemie, cukrovka a neurodegenerativní onemocnění. Jeho mechanismus působení a jeho bezpečnost však ještě musí být důkladně prozkoumány..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Fyzikální vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Hustota
- 3.6 Rozpustnost
- 4 Chemické vlastnosti
- 4.1 Ve vodném roztoku
- 4.2 Reakce s kyslíkem
- 4.3 Reakce s kovy
- 4.4 Reakce s oxidem siřičitým
- 4.5 Rozklad s teplotou
- 5 Poloha v přírodě
- 6 Syntéza v savčím organismu
- 7 Získané v laboratoři nebo průmyslově
- 8 Průmyslové využití H2S k výrobě síry
- 9 Užitečnost nebo důležitost endogenního H2S v těle
- 9.1 Kardiovaskulární systém
- 9.2 Gastrointestinální systém
- 9.3 Centrální nervový systém
- 9.4 Orgán vidění
- 9.5 Proti stárnutí
- 9.6 Léčivý potenciál exogenně dodávaného H2S
- 10 Rizika
- 11 Reference
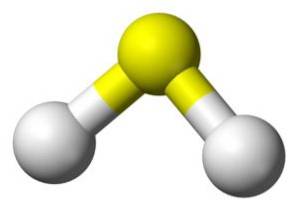
Struktura
Molekula HdvaS je analogický s vodou, to znamená, že mají podobný tvar, protože vodíky jsou umístěny v úhlu se sírou.
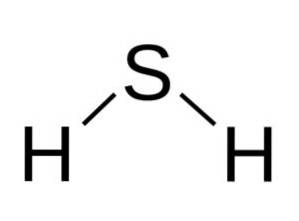
Síra v HdvaS má následující elektronickou konfiguraci:
1 sdva, 2 sdva 2 str6, 3 sdva 3p6,
Z každého vodíku si půjčí jeden elektron, aby dokončil svou valenční skořápku..
Nomenklatura
- Sirovodík
- Sirovodík
- Síra hydrid.
Fyzikální vlastnosti
Fyzický stav
Bezbarvý plyn se velmi nepříjemným zápachem.
Molekulární váha
34,08 g / mol.
Bod tání
-85,60 ° C.
Bod varu
-60,75 ° C.
Hustota
1,1906 g / l.
Rozpustnost
Středně rozpustný ve vodě: 2,77 objemů v 1 vodě při 20 ° C. Lze jej úplně uvolnit z vodného roztoku varem.
Chemické vlastnosti
Ve vodném roztoku
Pokud je sirovodík ve vodném roztoku, nazývá se to sirovodík. Je to slabá kyselina. Má dva ionizovatelné protony:
HdvaS + Hdva⇔ H3NEBO+ + HS-, K.a1 = 8,9 x 10-8
HS- + Hdva⇔ H3NEBO+ + Sdva-, K.a2 ∼ 10-14
První proton mírně ionizuje, jak lze odvodit z jeho první ionizační konstanty. Druhý proton ionizuje velmi málo, ale roztoky HdvaS obsahují část sulfidového aniontu Sdva-.
Pokud je řešení HdvaS je vystaven vzduchu, Odva oxiduje na sulfidový anion a vysráží síru:
2 Sdva- + 4 h+ + NEBOdva → 2 HdvaO + 2 S.0↓ (1)
V přítomnosti chlorudva, brom Brdva a jód Idva tvoří se odpovídající halogenovodík a síra:
HdvaS + Brdva → 2 HBr + S0↓ (2)
Vodné roztoky HdvaS jsou korozivní, vytvářejí praskliny na bázi sulfidového napětí u ocelí s vysokou tvrdostí. Produkty koroze jsou sulfid železa a vodík.
Reakce s kyslíkem
HdvaS reaguje s kyslíkem ve vzduchu a mohou nastat následující reakce:
2 hdvaS + 3 O.dva → 2 HdvaO + 2 SOdva (3)
2 hdvaS + Odva → 2 HdvaO + 2 S.0↓ (4)
Reakce s kovy
Reaguje s různými kovy, které vytlačují vodík a tvoří sulfid kovu:
HdvaS + Pb → PbS + Hdva↑ (5)
Reakce s oxidem siřičitým
V sopečných plynech, HdvaS a SOdva, které navzájem reagují a tvoří pevnou síru:
HdvaS + SOdva → 2 HdvaO + 3 S.0↓ (6)
Rozklad s teplotou
Sirovodík není příliš stabilní, při zahřátí se snadno rozkládá:
HdvaS → Hdva↑ + S0↓ (7)
Poloha v přírodě
Tento plyn se přirozeně nachází v sirných nebo sirných horkých pramenech, v sopečných plynech, v ropě a v zemním plynu..

Když olej (nebo plyn) obsahuje významné stopy HdvaO S se říká, že je „kyselá“, na rozdíl od „sladké“, což je situace, kdy ji neobsahuje.
Malé množství HdvaS v oleji nebo plynu jsou ekonomicky škodlivé, protože k jejich odstranění je nutné nainstalovat čisticí zařízení, aby se zabránilo korozi a aby byl odpadní plyn bezpečný pro domácí použití jako palivo.
Vyrábí se vždy, když se organická hmota obsahující síru rozloží za anaerobních podmínek (nepřítomnost vzduchu), jako je lidský, zvířecí a rostlinný odpad.

Bakterie přítomné v ústech a v gastrointestinálním traktu je produkují z rozložitelných materiálů obsažených v rostlinách nebo živočišných bílkovinách..
Díky své charakteristické vůni je patrný u shnilých vajec.
HdvaS se také vyrábí v určitých průmyslových činnostech, jako jsou ropné rafinerie, koksovací pece, papírny, koželužny a při zpracování potravin.
Syntéza v savčím organismu
HdvaEndogenní S může být produkován v savčích tkáních, včetně lidí, dvěma cestami, jednou enzymatickou a jednou neenzymatickou.
Neenzymatická cesta spočívá v redukci elementární síry S0 do HdvaS oxidací glukózy:
2 C.6H12NEBO6 (glukóza) + 6 S.0 (síra) + 3 HdvaO → 3 ° C3H6NEBO3 + 6 hdvaS + 3 COdva (8)
Enzymatická cesta spočívá v produkci HdvaS z L-cysteinu, což je aminokyselina syntetizovaná tělem. Proces je zajištěn několika enzymy, jako je například cystathionin-p-syntáza a cystathionin-y-lyáza..

Získávání v laboratoři nebo v průmyslu
Plynný vodík (Hdva) a prvek síra (S) nereagují za normálních teplot okolí, ale nad nimi se začínají kombinovat, přičemž optimální teplota je 310 ° C.
Proces je však příliš pomalý, proto se k jeho získání používají jiné metody, včetně následujících.
Sulfidy kovů (například sulfid železnatý) reagují s kyselinami (jako je kyselina chlorovodíková) ve zředěném roztoku.
FeS + 2 HCl → FeCldva + HdvaS ↑ (9)
Tímto způsobem plyn HdvaS, které musí být vzhledem ke své toxicitě bezpečně shromážděny.
Průmyslové použití HdvaS k výrobě síry
Skladování a přeprava ve velkém množství HdvaOddělování S od zemního plynu aminovým praním je obtížné, proto se k jeho přeměně na síru používá Clausův proces.

V tomto procesu dochází ke dvěma reakcím. V první HdvaS reaguje s kyslíkem za vzniku SOdva, jak je uvedeno výše (viz reakce 3).
Druhá je reakce katalyzovaná oxidem železa, kde SOdva se sníží a HdvaS oxiduje a oba produkují síru S (viz reakce 6).
Tímto způsobem se získává síra, kterou lze snadno skladovat a přepravovat a která je také určena pro více použití..
Užitečnost nebo důležitost HdvaS endogenní v těle
HdvaEndogenní S je ten, který se přirozeně vyskytuje v těle jako součást normálního metabolismu u lidí, savců a dalších živých bytostí.
Navzdory své dlouhodobé pověsti toxického a jedovatého plynu spojeného s rozkladem organické hmoty několik nedávných studií od 2000 do současnosti určilo, že HdvaEndogenní S je důležitým regulátorem určitých mechanismů a procesů v živé bytosti.
HdvaS má vysokou lipofilnost nebo afinitu k tukům, takže snadno prochází buněčnými membránami a proniká do všech typů buněk.
Kardiovaskulární systém
U savců sirovodík podporuje nebo reguluje řadu signálů, které regulují metabolismus, srdeční funkce a přežití buněk..
Má silný účinek na srdce, cévy a cirkulující prvky krve. Moduluje buněčný metabolismus a mitochondriální funkce.
Chrání ledviny před poškozením způsobeným ischemií.
Gastrointestinální systém
Hraje důležitou roli jako ochranný faktor před poškozením žaludeční sliznice. Odhaduje se, že může být důležitým mediátorem gastrointestinální motility.
Pravděpodobně se podílí na regulaci sekrece inzulínu.
Centrální nervový systém
Působí také při důležitých funkcích centrálního nervového systému a chrání neurony před oxidačním stresem.
Odhaduje se, že může chránit před neurodegenerativními chorobami, jako je Parkinsonova, Alzheimerova a Hungtintonova choroba.
Orgán vidění
Chrání retinální fotoreceptorové buňky před degenerací vyvolanou světlem.
Proti stárnutí
HdvaJelikož se jedná o redukční druh, může být konzumován různými oxidačními činidly, která cirkulují v těle. Bojuje proti oxidujícím látkám, jako jsou reaktivní formy kyslíku a reaktivní formy dusíku v těle.
Omezuje reakce volných radikálů aktivací antioxidačních enzymů, které chrání před účinky stárnutí.
Léčivý potenciál HdvaS dodáván exogenně
Biologická dostupnost HdvaEndogenní S závisí na určitých enzymech podílejících se na biosyntéze cysteinu u savců.
Některé studie naznačují, že H-dárce drogové terapiedvaS může být prospěšný pro určité patologie.
Mohlo by to být například užitečné u diabetických pacientů, protože bylo pozorováno, že krevní cévy diabetických zvířat se zlepšují pomocí léků dodávajících HdvaS exogenní.
HdvaS dodaným exogenně zvyšuje angiogenezi nebo tvorbu krevních cév, takže by mohl být použit k léčbě chronických ischemických chorob.
Vyvíjejí se léky, které mohou uvolňovat HdvaS pomalu, aby bylo možné příznivě působit na různé nemoci. Účinnost, bezpečnost a mechanismy jeho působení je však ještě třeba zkoumat..
Rizika
HdvaS je smrtelný jed při vdechování čistý nebo dokonce zředěný 1 díl plynu ve 200 dílech vzduchu. Ptáci jsou velmi citliví na H.dvaS a zemřou i při zředění 1 na 1 500 dílů vzduchu.

HdvaS je silný inhibitor určitých enzymů a procesů oxidativní fosforylace, což vede k udušení buněk. Většina lidí to cítí v koncentracích vyšších než 5 ppb (části na miliardu). Koncentrace 20–50 ppm (části na milion) dráždí oči a dýchací cesty.
Vdechnutí 100-250 ppm po dobu několika minut může způsobit nekoordinaci, poruchy paměti a motorické poruchy. Když je koncentrace kolem 150-200 ppm, dojde k čichové únavě nebo anosmii, což znamená, že poté nelze detekovat charakteristický zápach H.dvaS. Pokud je koncentrace 500 ppm inhalována po dobu 30 minut, může dojít k plicnímu edému a pneumonii..
Koncentrace vyšší než 600 ppm mohou být během prvních 30 minut fatální, protože je ochrnutý dýchací systém. A 800 ppm je koncentrace, která je pro člověka okamžitě smrtelná..
Je proto třeba se vyvarovat úniku HdvaS v laboratořích, prostorách nebo na jakémkoli místě či v jakékoli situaci.
Je důležité si uvědomit, že dochází k mnoha úmrtím, protože lidé vstupují do stísněných prostor, aby zachránili spolupracovníky nebo členy rodiny, kteří se zhroutili kvůli otravě H.dvaAno, taky je předám.
Je to hořlavý plyn.
Reference
- Panthi, S. a kol. (2016). Fyziologický význam sirovodíku: vznikající silný neuroprotektor a neuromodulátor. Oxidační medicína a buněčná dlouhověkost. Svazek 2016. ID článku 9049782. Obnoveno z hindawi.com.
- Shefa, U. a kol. (2018). Antioxidační a buněčné signalizační funkce sirovodíku v centrálním nervovém systému. Oxidační medicína a buněčná dlouhověkost. Svazek 2018. ID článku 1873962. Obnoveno z hindawi.com.
- Tabassum, R. a kol. (2020). Terapeutický význam sirovodíku u neurodegenerativních onemocnění souvisejících s věkem. Neural Regen Res 2020; 15: 653-662. Obnoveno z nrronline.org.
- Martelli, A. a kol. (2010). Sirovodík: nová příležitost pro objevování drog. Recenze lékařského výzkumu. Svazek 32, vydání 6. Obnoveno z onlinelibrary.wiley.com.
- Wang, M.-J. et al. (2010). Mechanismy angiogeneze: Úloha sirovodíku. Klinická a experimentální farmakologie a fyziologie (2010) 37, 764-771. Obnoveno z onlinelibrary.wiley.com.
- Dalefield, R. (2017). Kouř a jiné inhalační toxické látky. Sírovodík. Ve veterinární toxikologii pro Austrálii a Nový Zéland. Obnoveno ze sciencedirect.com.
- Selley, R.C. a Sonnenberg, S.A. (2015). Fyzikální a chemické vlastnosti ropy. Sírovodík. In Elements of Petroleum Geology (třetí vydání). Obnoveno ze sciencedirect.com.
- Hocking, M.B. (2005). Síra a kyselina sírová. Clausův proces přeměny sirovodíku na síru. In Handbook of Chemical Technology and Pollution Control (Third Edition). Obnoveno ze sciencedirect.com.
- Lefer, D.J. (2008). Potenciální význam změn v sirovodíku (HdvaS) biologická dostupnost při cukrovce. British Journal of Pharmacology (2008) 155, 617-619. Obnoveno z bpspubs.onlinelibrary.wiley.com.
- NÁS. Národní lékařská knihovna. (2019). Sirovodík. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Babor, J.A. a Ibarz, J. (1965). Moderní obecná chemie. 7. vydání. Redakční Marín, S.A.


Zatím žádné komentáře