
Struktura kyseliny sírové, vlastnosti, názvosloví, použití
The kyselina sírová je oxidová kyselina, která vzniká rozpuštěním oxidu siřičitého, SOdva, ve vodě. Je to slabá a nestabilní anorganická kyselina, která nebyla detekována v roztoku, protože reakce jejího vzniku je reverzibilní a kyselina se rychle rozkládá v činidlech, která ji produkovala (SOdva a HdvaNEBO).
Molekula kyseliny sírové byla dosud detekována pouze v plynné fázi. Konjugované báze této kyseliny jsou běžné anionty ve formě siřičitanů a hydrogensiřičitanů..
SWdva + HdvaNEBO <=> HSO3- + H+
To naznačuje, že při použití Ramanova spektra není možné detekovat přítomnost kyseliny sírové v roztoku oxidu siřičitého ve vodě..
Při vystavení atmosféře se rychle mění na kyselinu sírovou. Kyselina sírová se redukuje na sirovodík působením zředěné kyseliny sírové a zinku.
Pokus o koncentraci řešení OSdva odpařováním vody za získání bezvodé kyseliny sírové nepřineslo výsledky, protože se kyselina rychle rozkládá (obrácení reakce tvorby), takže kyselinu nelze izolovat.
Rejstřík článků
- 1 Přírodní útvar
- 2 Struktura
- 2.1 Izolovaná molekula
- 2.2 Molekula obklopená vodou
- 2.3 SO2 ∙ nH2O
- 3 Fyzikální a chemické vlastnosti
- 3.1 Molekulární vzorec
- 3,2 Molekulová hmotnost
- 3.3 Fyzický vzhled
- 3.4 Hustota
- 3.5 Hustota par
- 3.6 Korozivita
- 3.7 Rozpustnost ve vodě
- 3.8 Citlivost
- 3.9 Stabilita
- 3,10 konstanta kyselosti (Ka)
- 3,11 pKa
- 3,12 pH
- 3.13 Bod vzplanutí
- 3.14 Rozklad
- 4 Názvosloví
- 5 Syntéza
- 6 použití
- 6.1 Ve dřevě
- 6.2 Dezinfekční a bělící prostředek
- 6.3 Konzervační prostředek
- 6.4 Jiná použití
- 7 Reference
Přirozený útvar
Kyselina sírová vzniká v přírodě kombinací oxidu siřičitého, produktu činnosti velkých továren, s atmosférickou vodou. Z tohoto důvodu je považován za meziprodukt kyselých dešťů, který způsobuje velké škody na zemědělství a životním prostředí..
Jeho kyselá forma není v přírodě použitelná, ale obvykle se připravuje ve formě solí, siřičitanu a hydrogensiřičitanu sodného a draselného..
Siřičitan je v těle endogenně generován v důsledku metabolismu aminokyselin obsahujících síru. Podobně se siřičitan vyrábí jako produkt fermentace potravin a nápojů. Siřičitan je alergenní, neurotoxický a metabolický. Je metabolizován enzymem sulfit oxidázou, který jej přeměňuje na sulfát, neškodnou sloučeninu.
Struktura
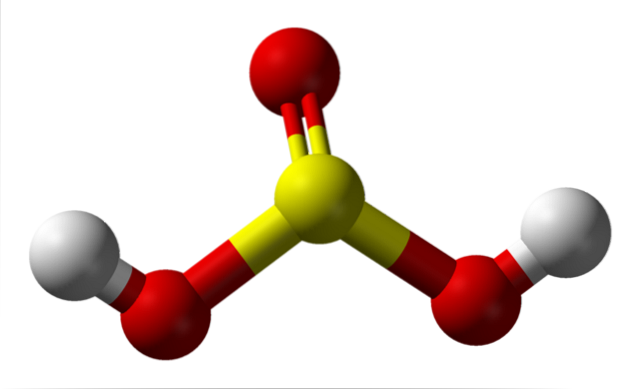
Izolovaná molekula
Na obrázku vidíte strukturu izolované molekuly kyseliny sírové v plynném stavu. Žlutá koule uprostřed odpovídá atomu síry, červená atomům kyslíku a bílá atomům vodíku. Jeho molekulární geometrie kolem atomu S je trigonální pyramida, přičemž atomy O kreslí základnu.
Pak, v plynném stavu, molekuly HdvaSW3 lze považovat za malé trigonální pyramidy plovoucí ve vzduchu, za předpokladu, že je dostatečně stabilní, aby nějakou dobu vydržel bez reakce.
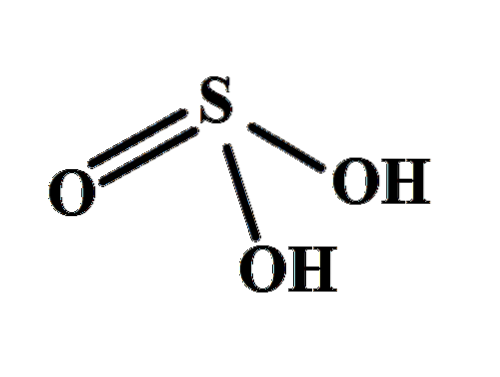
Struktura objasňuje, odkud pocházejí dva kyselé vodíky: ze sírou vázaných hydroxylových skupin HO-SO-OH. Proto pro tuto sloučeninu není správné předpokládat, že jeden z kyselých protonů, H+, se uvolňuje z atomu síry, H-SOdva(ACH).
Dvě skupiny OH umožňují interakci kyseliny sírové prostřednictvím vodíkových vazeb a navíc je kyslík vazby S = O akceptorem vodíku, který převádí HdvaSW3 dobrý dárce i příjemce těchto mostů.
Podle výše uvedeného je HdvaSW3 by měl být schopen kondenzovat na kapalinu, stejně jako kyselina sírová, HdvaSW4. Tak se to ale neděje.
Molekula obklopená vodou
Doposud nebylo možné získat bezvodou kyselinu sírovou, tj. HdvaSW3(l); zatímco HdvaSW4(ac), na druhé straně se po dehydrataci transformuje do své bezvodé formy, HdvaSW4(l), což je hustá a viskózní kapalina.
Pokud se předpokládá, že molekula HdvaSW3 zůstane nezměněn, bude se moci do značné míry rozpustit ve vodě. Interakce, které by v uvedených vodných roztocích vládly, by opět byly vodíkové vazby; Elektrostatické interakce by však existovaly také v důsledku rovnováhy hydrolýzy:
HdvaSW3(ac) + HdvaO (l) <=> HSO3-(ac) + H3NEBO+(ac)
HSO3-(ac) + HdvaO (l) <=> SW3dva-(ac) + H3NEBO+
Siřičitanový iont, SO3dva- Byla by to stejná molekula jako výše, ale bez bílých koulí; a ion hydrogensiřičitanu (nebo hydrogensiřičitanu), HSO3-, zachovává bílou kouli. Nekonečnosti solí mohou vzniknout z obou aniontů, některé jsou nestabilnější než jiné.
Ve skutečnosti se potvrdilo, že extrémně malou část řešení tvoří HdvaSW3; to znamená, že vysvětlená molekula není ta, která interaguje přímo s molekulami vody. Důvodem je to, že prochází rozkladem způsobujícím SOdva a HdvaNebo, což je termodynamicky výhodné.
SWdva∙nHdvaNEBO
Skutečnou strukturu kyseliny sírové tvoří molekula oxidu siřičitého obklopená sférou vody, která je tvořena n molekulami..
Tedy SOdva, jehož struktura je úhlová (typ bumerangu), spolu s jeho vodnatou sférou, je zodpovědná za kyselé protony, které charakterizují kyselost:
SWdva∙ nHdvaO (ac) + HdvaO (l) <=> H3NEBO+(ac) + HSO3-(ac) + nHdvaO (l)
HSO3-(ac) + HdvaO (l) <=> SW3dva-(ac) + H3NEBO+
Kromě této rovnováhy existuje také rovnováha rozpustnosti pro SOdva, jehož molekula může uniknout z vody do plynné fáze:
SWdva(G) <=> SWdva(ac)
Fyzikální a chemické vlastnosti
Molekulární vzorec
HdvaSW3
Molekulární váha
82,073 g / mol.
Fyzický vzhled
Je to bezbarvá kapalina s pronikavým zápachem síry.
Hustota
1,03 g / ml.
Hustota par
2.3 (ve vztahu ke vzduchu odebranému jako 1)
Žíravost
Je korozivní pro kovy a tkaniny.
Rozpustnost ve vodě
Mísitelný s vodou.
Citlivost
Je citlivý na vzduch.
Stabilita
Stabilní, ale nekompatibilní se silnými bázemi.
Konstanta kyselosti (Ka)
1,54 x 10-dva
pKa
1.81
pH
1,5 na stupnici pH.
bod vznícení
Nehořlavý.
Rozklad
Při zahřátí se může kyselina sírová rozkládat a vydávat toxický kouř oxidu siřičitého..
Nomenklatura
Síra má následující valence: ± 2, +4 a +6. Ze vzorce HdvaSW3, lze vypočítat valenční nebo oxidační číslo síry ve sloučenině. K tomu stačí vyřešit algebraický součet:
2 (+1) + 1v + 3 (-2) = 0
Jelikož se jedná o neutrální sloučeninu, součet nábojů atomů, které ji tvoří, musí být 0. Řešení pro v pro předchozí rovnici máme:
v = (6-2) / 1
V se tedy rovná +4. To znamená, že síra se účastní druhé valence a podle tradiční nomenklatury musí být k názvu přidána přípona -oso. Z tohoto důvodu v HdvaSW3 je známá jako kyselina sírovámedvěd.
Další rychlejší způsob určení této valence je porovnáním HdvaSW3 s H.dvaSW4. V HdvaSW4 síra má valenci +6, takže pokud je O odstraněno, valence klesne na +4; a pokud se odstraní další, valence klesne na +2 (což by byl případ kyseliny škytavkasíramedvěd, HdvaSWdva).
Ačkoli méně známý, k HdvaSW3 Podle základní nomenklatury může být také nazývána kyselina trioxosulfurová (IV).
Syntéza
Technicky se tvoří spalováním síry za vzniku oxidu siřičitého. Ten se poté rozpustí ve vodě za vzniku kyseliny sírové. Reakce je však reverzibilní a kyselina se rychle rozkládá zpět na reaktanty..
Toto je vysvětlení, proč se kyselina sírová ve vodném roztoku nenachází (jak již bylo uvedeno v části o její chemické struktuře).
Aplikace

Obecně se použití a aplikace kyseliny sírové, protože její přítomnost nelze zjistit, týká použití a aplikací roztoků oxidů sírových a zásad a solí kyseliny..
Ve dřevě
Při sulfitovém procesu se dřevní buničina vyrábí ve formě téměř čistých celulózových vláken. Různé soli kyseliny sírové se používají k extrakci ligninu z dřevní štěpky pomocí vysokotlakých nádob nazývaných digistory..
Soli používané při získávání buničiny ze dřeva jsou siřičitany (SO3dva-) nebo hydrogensiřičitan (HSO3-), v závislosti na pH. Protiiontem může být Na+, ACdva+, K.+ nebo NH4+.
Dezinfekční a bělící prostředek
-Jako dezinfekční prostředek se používá kyselina sírová. Používá se také jako jemné bělící činidlo, zejména pro materiály citlivé na chlór. Kromě toho se používá jako bělení zubů a přísada do potravin.
-Je přísadou do různé kosmetiky pro péči o pleť a byl používán jako pesticidní prvek při eliminaci potkanů. Odstraňuje skvrny způsobené vínem nebo ovocem na různých látkách.
-Slouží jako antiseptikum a je účinný při prevenci kožních infekcí. V některých okamžicích byl používán při fumigacích k dezinfekci lodí, věcí nemocných obětí epidemií atd..
Konzervační prostředek
Kyselina sírová se používá jako konzervační prostředek pro ovoce a zeleninu a jako prevence proti kvašení nápojů, jako je víno a pivo, je antioxidačním, antibakteriálním a fungicidním prvkem..
Jiná použití
-Kyselina sírová se používá při syntéze léčiv a chemikálií; při výrobě vína a piva; rafinace ropných produktů; a používá se jako analytické činidlo.
-Bisulfit reaguje s pyrimidinovými nukleosidy a přidává se k dvojné vazbě mezi polohou 5 a 6 pyrimidinu a modifikuje tak vazbu. Bisulfitová transformace se používá k testování sekundárních nebo vyšších struktur polynukleotidů.
Reference
- Wikipedia. (2018). Kyselina sírová. Obnoveno z: en.wikipedia.org
- Názvosloví kyselin. [PDF]. Obnoveno z: 2.chemistry.gatech.edu
- Voegele F. Andreas a spol. (2002). O stabilitě kyseliny sírové (HdvaSW3) a jeho dimer. Chem. Eur. J. 2002. 8, č. 24.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání., S. 393). Mc Graw Hill.
- Calvo Flores F. G. (s.f.). Formulace anorganické chemie. [PDF]. Obnoveno z: ugr.es
- PubChem. (2018). Kyselina sírová. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Steven S. Zumdahl. (15. srpna 2008). Okyselina. Encyklopedie Britannica. Obnoveno z: britannica.com


Zatím žádné komentáře