
Struktura, vlastnosti a použití kyseliny jodovodíkové (HI)

The kyselina jodovodíková Jedná se o vodný roztok jodovodíku, který se vyznačuje vysokou kyselostí. Definice blížící se chemické a IUPAC terminologii je, že se jedná o hydracid, jehož chemický vzorec je HI.
Aby se však odlišil od plynných molekul jodovodíku, HI (g) se označuje HI (aq). Z tohoto důvodu je v chemických rovnicích důležité identifikovat střední nebo fyzikální fázi, ve které se reaktanty a produkty nacházejí. Přesto je běžná záměna mezi jodovodíkem a kyselinou jodovodíkovou..
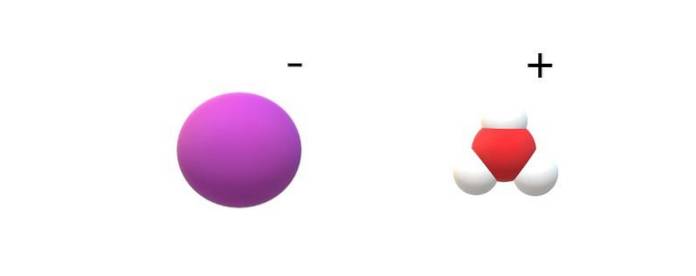
Pokud jsou pozorovány molekuly spáchané v jejich identitě, budou patrné znatelné rozdíly mezi HI (g) a HI (ac). V HI (g) existuje vazba H-I; zatímco v HI (ac) jsou vlastně iontový pár I.- a H3NEBO+ elektrostatická interakce (horní obrázek).
Na druhé straně je HI (ac) zdrojem HI (g), protože první se připravuje rozpuštěním druhého ve vodě. Z tohoto důvodu, pokud to není v chemické rovnici, lze HI použít také pro označení kyseliny jodovodíkové. HI je silné redukční činidlo a vynikající zdroj iontů iontů.- ve vodném prostředí.
Rejstřík článků
- 1 Struktura kyseliny jodovodíkové
- 2 Vlastnosti
- 2.1 Fyzický popis
- 2.2 Molekulová hmotnost
- 2.3 Zápach
- 2.4 Hustota
- 2.5 Bod varu
- 2,6 pKa
- 2.7 Kyselost
- 2.8 Redukční činidlo
- 3 Názvosloví
- 4 použití
- 4.1 Zdroj jódu v organické a anorganické syntéze
- 4.2 Redukční činidlo
- 4.3 Proces Cativa
- 4.4 Nedovolené syntézy
- 5 Reference
Struktura kyseliny jodovodíkové
Kyselina jodovodíková, jak již bylo vysvětleno, sestává z roztoku HI ve vodě. Ve vodě se molekuly HI úplně disociují (silný elektrolyt) a vznikají ionty I- a H3NEBO+. Tuto disociaci lze vyjádřit následující chemickou rovnicí:
HI (g) + HdvaO (l) => I-(ac) + H3NEBO+(ac)
Co by bylo ekvivalentní, kdyby to bylo napsáno jako:
HI (g) + HdvaO (l) => HI (ac)
HI (ac) však vůbec neodhaluje, co se stalo s plynnými molekulami HI; pouze to naznačuje, že jsou ve vodném médiu.
Skutečnou strukturu HI (ac) proto tvoří ionty I- a H3NEBO+ obklopen molekulami vody, které je hydratují; čím koncentrovanější je kyselina jodovodíková, tím nižší je počet neprotonovaných molekul vody.
Komerčně je ve skutečnosti koncentrace HI ve vodě 48 až 57%; koncentrovanější by se rovnalo přílišné dýmavé kyselině (a ještě nebezpečnější).
Na obrázku je vidět, že anion I- je reprezentováno fialovou koulí a H3NEBO+ s bílými koulemi a červenou pro atom kyslíku. Kation H3NEBO+ obsahuje molekulární geometrii trigonální pyramidy (při pohledu z vyšší roviny na obrázku).
Vlastnosti
Fyzický popis
Bezbarvá kapalina; ale při přímém kontaktu s kyslíkem může vykazovat nažloutlé a hnědé tóny. Je to proto, že ionty I- nakonec oxiduji na molekulární jód, Idva. Pokud je toho hodně jádva, je více než pravděpodobné, že se vytvoří trijodidový anion, I3-, který zabarví roztok do hnědé barvy.
Molekulová hmotnost
127,91 g / mol.
Zápach
Akr.
Hustota
Hustota je 1,70 g / ml pro 57% HI roztok; protože hustoty se liší v závislosti na různých koncentracích HI. Při této koncentraci se vytvoří azeotrop (destiluje se jako jediná látka a nikoli jako směs), k jehož relativní stabilitě může dojít díky jeho komercializaci nad jinými roztoky..
Bod varu
57% HI azeotrop vaří při 127 ° C při tlaku 1,03 baru (PŘEJÍT DO ATM).
pKa
-1,78.
Kyselost
Je to extrémně silná kyselina natolik, že je korozivní pro všechny kovy a tkaniny; i na gumy.
Je to proto, že vazba H-I je velmi slabá a během ionizace ve vodě se snadno rozbije. Dále vodíkové vazby I- - HOHdva+ jsou slabé, takže není nic, co by rušilo H3NEBO+ reagovat s jinými sloučeninami; to je H3NEBO+ byl „zdarma“, jako já- to nepřitahuje příliš velkou silou na jeho protiion.
Redukční prostředek
HI je silné redukční činidlo, jehož hlavním reakčním produktem je Idva.
Nomenklatura
Nomenklatura pro kyselinu jodovodíkovou je odvozena od skutečnosti, že jód „pracuje“ v jediném oxidačním stavu: -1. Stejný název také naznačuje, že má vodu ve svém strukturním vzorci [I.-] [H3NEBO+]. Toto je jeho jediný název, protože nejde o čistou sloučeninu, ale o řešení.
Aplikace
Zdroj jódu v organické a anorganické syntéze
HI je vynikajícím zdrojem iontů I- pro anorganické a organické syntézy a je také silným redukčním činidlem. Například jeho 57% vodný roztok se používá pro syntézu alkyljodidů (jako je CH3CHdvaI) z primárních alkoholů. Podobně skupina OH může být ve struktuře substituována za I.
Redukční prostředek
Kyselina jodovodíková se používá například k redukci sacharidů. Pokud se glukóza rozpuštěná v této kyselině zahřeje, ztratí všechny své OH skupiny a získá uhlovodíkový n-hexan jako produkt..
Podobně se používá ke snížení funkčních skupin grafenových listů takovým způsobem, že mohou být funkcionalizovány pro elektronická zařízení..
Proces Cativa

Kroky
Proces začíná (1) organo-iridiovým komplexem [Ir (CO)dvaJádva]-, geometrie čtvercové roviny. Tato sloučenina "přijímá" methyljodid, CH3I, produkt okyselení CH3OH s 57% HI. Při této reakci se také vyrábí voda a díky ní se nakonec získá kyselina octová, přičemž v posledním kroku se umožní zpětné získání HI..
V tomto kroku skupina -CH3 jako -I se vážou na kovové centrum iridia (2) a tvoří oktaedrický komplex s fazetou složenou ze tří ligandů I. Jedna z jodů je nakonec nahrazena molekulou oxidu uhelnatého, CO; a nyní (3) má oktaedrický komplex aspekt složený ze tří CO ligandů.
Pak dojde k přeskupení: skupina -CH3 „uvolňuje“ se z Ir a váže se na sousední CO (4) za vzniku acetylové skupiny -COCH3. Tato skupina se uvolňuje z iridiového komplexu a váže se na jodidové ionty a dává CH3COI, acetyljodid. Zde se získá iridiový katalyzátor připravený k účasti v dalším katalytickém cyklu.
Nakonec CH3MOV podstoupí výměnu I- na jednu molekulu HdvaO, jehož mechanismus nakonec uvolní HI a kyselinu octovou.
Nedovolené syntézy

Je vidět, že nejdříve nastává substituce OH skupiny za I, následuje druhá substituce za H.
Reference
- Wikipedia. (2019). Kyselina jodovodíková. Obnoveno z: en.wikipedia.org
- Andrews, Natalie. (24. dubna 2017). Použití kyseliny jodovodíkové. Vědění. Obnoveno z: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Kyselina jodovodíková. Obnoveno z: alfa.com
- Národní centrum pro biotechnologické informace. (2019). Kyselina jodovodíková. PubChem Database., CID = 24841. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Ilustrovaný glosář organické chemie: kyselina jodovodíková. Obnoveno z: chem.ucla.edu
- Reusch William. (5. května 2013). Sacharidy. Obnoveno z: 2.chemistry.msu.edu
- V dílech Kyu Moon, Junghyun Lee, Rodney S. Ruoff a Hyoyoung Lee. (2010). Snížený oxid grafenu chemickou grafitizací. DOI: 10,1038 / ncomms1067.



Zatím žádné komentáře