
Struktura cytochrom c oxidázy, funkce, inhibitory
The cytochrom c oxidáza Jedná se o komplex enzymatických proteinů, které mohou procházet lipidovou dvojvrstvou buněčné membrány. Je hemosolubilní a je spojován hlavně s vnitřní membránou mitochondrií, vyskytuje se jak v prokaryotických organismech (bakterie), tak v eukaryotech (jednobuněčné a mnohobuněčné)..
Tento enzym, nazývaný také komplex IV, je životně důležitý v aerobních metabolických funkcích organismů, protože je nezbytný v řetězci transportu elektronů, ve kterém buňka spaluje cukry a zachycuje část energie uvolněné k ukládání adenosintrifosfátu nebo ATP..
Název cytochrom znamená „buněčné pigmenty“. Jedná se o krevní proteiny, které přenášejí elektrony. Cytochromy objevil irský lékař Charles Alexander MacMunn v roce 1884. MacMunn byl průkopníkem v objevu respiračního pigmentu v krvi, dnes nazývaného cytochrom 1..
Ve 20. letech 20. století ruský entomolog a parazitolog David Keilin znovu objevil a charakterizoval respirační pigmenty a jako jediný je pojmenoval cytochromy. Ačkoli je MacMunn objevil v roce 1884, vědecká komunita na něj zapomněla a někteří dokonce jeho práci špatně interpretovali..
Rejstřík článků
- 1 Obecná charakteristika
- 1.1 - Cytochrom c
- 2 Cytochrom c oxidáza nebo komplex IV
- 3 Struktura
- 4 funkce
- 4.1 Apoptóza nebo programovaná buněčná smrt
- 4.2 Regenerace buněk nebo tkání
- 4.3 Energetický metabolismus
- 5 inhibitorů
- 6 Nedostatek
- 7 Použití ve fylogenezi
- 8 Reference
Obecná charakteristika
Obecně mají respirační pigmenty charakteristická spektra viditelného světla. Je známo, že existují nejméně čtyři integrální komplexy membránových proteinů, kde existuje 5 různých typů cytochromů: a, a3, b, c1 a c, klasifikovaných podle vlnových délek maxim spektrální absorpce.
Obvykle se nacházejí na vnitřní membráně mitochondrií. Byly však také pozorovány v endoplazmatickém retikulu a chloroplastech, v eukaryotických a prokaryotických organismech..
Představují hemovou protetickou skupinu obsahující železo (Fe). Každý ze známých cytochromů působí v multienzymových komplexech při transportu elektronů v dýchacím procesu nebo řetězci..
Cytochromy mají funkci účasti na oxidačně-redukčních reakcích. Redukční reakce, kde přijímají elektrony, se u každého typu cytochromu vyskytují odlišně a jejich hodnota je určena tokem elektronů z dýchacího řetězce.
-Cytochrom c
Jsou známy čtyři třídy cytochromu c, které jsou následující.
Třída I.
V této třídě jsou rozpustné cytochromy c (lowspin) s nízkým spinem přítomné v bakteriích a mitochondriích. Jsou oktaedrické. Hemové vazebné místo je na N-konci histidinu a šestý ligand je dodáván methioninovým zbytkem na C-konci..
Z této třídy lze dokonce rozpoznat několik podtříd, jejichž trojrozměrná struktura byla určena..
Třída II
V této třídě se nachází cytochrom c s vysokým spinem a některý cytochrom c s nízkým spinem. Ty s vysokým obratem mají vazebné místo blízko C-konce a v těch s nízkým obratem se zdá, že šestý ligand je methioninový zbytek poblíž N-konce. Jsou pentakoordinovány s histidinem pátého ligandu.
Třída III
Tato třída je charakterizována prezentací cytochromů c s více hemy (c3 a c7) a nízkým potenciálem redukce oxidů, pouze s 30 aminokyselinovými zbytky na skupinu hemu. V představitelích této třídy mají skupiny hemu c neekvivalentní strukturu a funkce, kromě toho, že představují různé redoxní potenciály. Jsou oktaedrické.
Třída IV
Podle některých autorů byla tato třída vytvořena pouze proto, aby zahrnovala komplexní proteiny, které představují jiné protetické skupiny, a mimo jiné i hem c nebo flavocytochrom c..
Cytochrom c oxidáza nebo komplex IV
Cytochrom c oxidáza je mitochondriální enzym, který provádí závěrečnou fázi transportu elektronů v buněčném dýchání. Tento enzym katalyzuje transport elektronů ze sníženého cytochromu c na kyslík..
Některé chemické sloučeniny, jako je kyanid, oxid uhličitý a azid, mohou inhibovat fungování tohoto enzymu a způsobit takzvanou buněčnou chemickou asfyxii. Jiné formy inhibice komplexu IV jsou genetické mutace.
Z evolučního hlediska se cytochrom c oxidáza vyskytuje pouze v aerobních organismech a několik skupin vědců naznačuje, že přítomnost tohoto proteinu naznačuje evoluční vztahy, kde rostliny, houby a také zvířata sdílely společného předka.
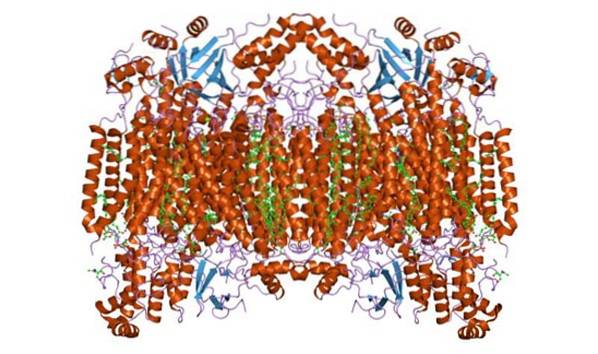
Struktura
Cytochrom c oxidáza tvoří homodimerní komplex, tj. Složený ze dvou podobných monomerů ve vnitřní membráně mitochondrií. Enzymový komplex se skládá ze 3 až 4 podjednotek v prokaryotických organismech a až z maxima 13 (některé naznačují 14) polypeptidů v organismech, jako jsou savci..
V těchto organismech jsou 3 polypeptidy mitochondriálního původu a zbytek pochází z jádra. Každý monomer má 28 transmembránových šroubovic, které oddělují hydrofilní domény proti membránové matrici a mezimembránovému prostoru..
Má jedinou katalytickou jednotku, která se nachází ve všech enzymech, které katalyzují oxidační / redukční reakce, za použití molekulárního kyslíku (oxidázy, zejména hem-měď). Komplex obsahuje cytochromy a a a3 spojené podjednotkou I a dvěma měděnými centry.
Má jednu nebo více skupin hemu C spojených s okolní strukturou proteinu jednou nebo více (obecně dvěma) thioetherovými vazbami. Jiní autoři naznačují, že mezi porfyrinovým kruhem a dvěma cysteinovými zbytky je kovalentně navázána jedna skupina hemu C..
Jediná výše uvedená skupina hemu c je obklopena hydrofobními zbytky a je hexakoordinovaná, s histidinem v poloze 18 polypeptidového řetězce a methioninem v poloze 80..
Funkce
Cytochrom c oxidázy jsou protagonisty tří hlavních fyziologických mechanismů, které uvidíme níže.
Apoptóza nebo programovaná buněčná smrt
Apoptóza je programovaná destrukce nebo smrt buněk způsobená samotným organismem, jejímž účelem je kontrola růstu, vývoje, eliminace poškozených tkání a regulace imunitního systému. V tomto fyziologickém procesu se cytochrom c oxidáza účastní jako meziprodukt.
Tento protein uvolňovaný mitochondriemi vede k interakci s endoplazmatickým retikulem, které způsobuje sekreci nebo uvolňování vápníku. Postupné zvyšování vápníku spouští masivní uvolňování cytochrom c oxidázy, dokud není dosaženo cytotoxických hladin vápníku..
Cytotoxické hladiny vápníku a uvolňování cytochromů c způsobují kaskádovou aktivaci několika kaspázových enzymů, které jsou odpovědné za destrukci buněk.
Regenerace buněk nebo tkání
Několik studií naznačuje, že když je cytochrom c oxidáza vystavena vlnovým délkám 670 nanometrů, podílí se na funkčním komplexu, který proniká do poškozené nebo poraněné tkáně a zvyšuje rychlost regenerace buněk..
Energetický metabolismus
Toto je možná nejznámější a nejdůležitější funkce cytochrom c oxidázy. Je to právě oxidázový komplex (dýchacího řetězce), který je zodpovědný za sbírání elektronů z cytochromu c a jejich přenos do molekuly kyslíku, čímž se redukuje na dvě molekuly vody..
V souvislosti s tímto procesem dochází k translokaci protonů přes membránu, což vede ke generování elektrochemického gradientu, který komplex ATP syntetáza používá k produkci nebo syntéze ATP (adenosintrifosfát)..
Inhibitory
Cytochrom c oxidáza je inhibována různými chemickými sloučeninami a procesy. Způsob, jakým k němu dochází, může vzniknout jako přirozený způsob regulace produkce nebo působení enzymu, nebo k němu může dojít náhodně v důsledku otravy.
V přítomnosti azidu, kyanidu nebo oxidu uhelnatého se na ně váže cytochrom c oxidáza a inhibuje se fungování proteinového komplexu. To způsobí přerušení buněčného dýchacího procesu, a proto způsobí chemické udušení buněk..
Jiné sloučeniny, jako je oxid dusnatý, sirovodík, methanol a některé methylované alkoholy, také způsobují inhibici cytochrom c oxidázy..
Nedostatek
Cytochrom c oxidáza je enzym, který je řízen geny jak v jádře, tak v mitochondriích. Existují genetické změny nebo mutace, které mohou vést k nedostatku cytochrom c oxidázy.
Tyto mutace narušují funkčnost enzymu, protože mění jeho enzymatickou strukturu a přinášejí s sebou metabolické poruchy během embryonálního vývoje (podle studií na lidech), které později ovlivní organismus v jeho prvních letech života..
Nedostatek cytochrom c oxidázy ovlivňuje tkáně s vysokou spotřebou energie, jako jsou srdce, játra, mozek a svaly. Příznaky těchto mutací se projeví před dvěma roky života a mohou se projevit jako silné nebo mírné stavy.
Mírné příznaky lze pozorovat i krátce po prvním roce věku a jedinci s nimi mají obvykle pouze snížené svalové napětí (hypotonii) a svalovou atrofii (myopatii)..
Na druhé straně jedinci se silnějšími příznaky mohou mít svalovou atrofii a encefalomyopatii. Dalšími stavy způsobenými absencí cytochrom c oxidázy jsou hypertrofická kardiomyopatie, patologické zvětšení jater, Leighův syndrom a laktátová acidóza..
Používá se ve fylogenezi
Fylogeneze je věda, která je zodpovědná za studium původu, formování a evolučního vývoje organismů z hlediska předků a potomků. V posledních desetiletích jsou fylogenetické studie s molekulární analýzou stále častější a přinášejí spoustu informací a řeší taxonomické problémy..
V tomto smyslu některé fylogenetické studie naznačují, že použití cytochrom c oxidáz může pomoci vytvořit evoluční vztahy. Je to proto, že tento proteinový komplex je vysoce konzervovaný a je přítomen v široké škále organismů, od jednobuněčných protistů až po velké obratlovce..
Příkladem toho jsou testy provedené na lidech, šimpanzích (Paniskový chléb) a makaků rhesus (Macaca mulatta). Takové testy odhalily, že lidské a šimpanzí cytochrom c oxidázy byly identické..
Rovněž se ukázalo, že molekuly cytochrom c oxidázy makaka rhesusového se lišily o jednu aminokyselinu od aminokyselin prvních dvou, což následně potvrdilo vztahy mezi předky a potomky mezi šimpanzi a lidmi..
Reference
- R.P. Ambler (1991). Variabilita sekvence v bakteriálních cytochromech c. Biochimica et Biophysica Acta (BBA) - bioenergetika.
- Cytochrom c. Obnoveno z newworldencyclopedia.org.
- V. Colman, E. Costa, R. Chaves, V. Tórtora (2015). Biologické role cytochromu c: mitochondriální transport elektronů, programovaná buněčná smrt a zisk aktivity peroxidu. Letopis lékařské fakulty.
- Cytochrom c oxidáza podjednotka I. Obnoveno z ebi.ac.uk.
- L. Youfen, P. Jeong-Soon, D. Jian-Hong & B. Yidong (2007). Cytochrom c oxidáza podjednotka IV je nezbytná pro shromáždění a respirační funkci enzymového komplexu. Journal of Bioenergetics and Biomembranes.
- Genová skupina: Mitochondriální komplex IV: podjednotky cytochrom c oxidázy (COX, MT-CO). Obnoveno z genenames.org.
- E.F. Hartree (1973). Objev cytochromu. Biochemické vzdělávání.
- Cytochrom c oxidáza, nedostatek…. Obnoveno z ivami.com.
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemie. 3. vydání. Benjamin / Cummings Publishing Company, Inc..



Zatím žádné komentáře