
Vlastnosti, rizika a použití chloridu lithného (LiCl)
The Chlorid lithný Jedná se o chemickou sloučeninu vzorce LiCl, kterou lze vyrobit zapálením lithia a chloru, i když je to obtížné, protože reakce je prudká. Tímto způsobem se vyrábí bezvodá forma (bez vody). Chlorid lithný lze také extrahovat z jiných chloridů alkalických kovů amylalkoholem..
Až do 90. let na trhu s kovem a lithiem dominovala produkce USA z ložisek nerostných surovin. Na počátku 21. století však většina produkce pocházela z neamerických zdrojů, přičemž nejdůležitějšími dodavateli na světě jsou Austrálie, Chile a Portugalsko..
Jako zajímavost stojí za zmínku, že ačkoli Bolívie má polovinu světových ložisek lithia, není velkým producentem.
Nejdůležitější obchodní formou je uhličitan lithný, LidvaCO3, vyráběné z minerálů nebo solných roztoků několika různými procesy.
Přidáním kyseliny chlorovodíkové (HCl) se získá chlorid lithný. Pomocí této metody se vyrábí hydratovaná sloučenina (voda vázaná na molekulu). Hydratovaná forma může být sušena na bezvodou formu zahříváním plynným chlorovodíkem..
Fyzikální a chemické vlastnosti chloridu lithného
Chlorid lithný je bílá pevná látka bez zvláštního aroma a slané chuti (National Center for Biotechnology Information, 2005). Jeho vzhled je znázorněn na obrázku 2.

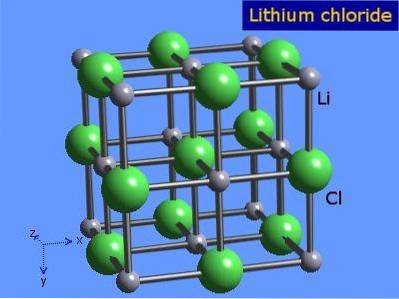
Chlorid lithný jsou vysoce hygroskopické krystaly s oktaedrickou geometrií podobnou jako chlorid sodný. Jeho krystalická struktura je uvedena na obrázku 3 (Winter, S.F.).
Jeho molekulová hmotnost je 42,39 g / mol, jeho hustota je 2,068 g / ml a jeho teploty tání a varu jsou 605 ° C a 1360 ° C..
Sloučenina je velmi rozpustná ve vodě, alkoholu, etheru, pyridinu a nitrobenzenu (Royal Society of Chemistry, 2015).
Chlorid lithný má slabý oxidační nebo redukční výkon. Stále však mohou nastat redoxní reakce. Roztoky chloridu lithného nejsou obecně ani silně kyselé, ani silně zásadité..
Protože je chlorid lithný extrémně hygroskopický, může také absorbovat až čtyři ekvivalenty amoniaku na mol. Vodné roztoky chloridu lithného mohou korodovat kovy (LITHIUM CHLORIDE, S.F.).
Reaktivita a nebezpečí
Chlorid lithný je stabilní sloučenina nekompatibilní se silnými oxidačními činidly, silnými kyselinami, chloridem bromitým, fluoridem bromitým.
Není toxický při požití, ale vzhledem ke své korozivní povaze může dráždit při kontaktu s pokožkou a očima, může dráždit také nosní cesty (National Institute for Occupational Safety and Health, 2015).
V případě kontaktu s očima zkontrolujte, zda nosíte kontaktní čočky, a ihned je vyjměte..
Oči by měly být proplachovány tekoucí vodou po dobu nejméně 15 minut, přičemž víčka udržujte otevřená. Lze použít studenou vodu. Oční mast by se neměla používat.
Pokud chemikálie přijde do styku s oděvem, co nejdříve ji odstraňte, abyste si chránili ruce a tělo.
Umístěte postiženého pod bezpečnostní sprchu. Pokud se chemikálie hromadí na exponované pokožce oběti, například na rukou, kontaminovaná kůže se jemně a opatrně omyje tekoucí vodou a neabrazivním mýdlem..
Lze použít studenou vodu. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc. Kontaminovaný oděv před dalším použitím vyperte.
V případě vdechnutí by měl být postižený ponechán v klidu na dobře větraném místě. Pokud je vdechnutí těžké, měla by být oběť co nejdříve evakuována do bezpečného prostoru..
Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata. Pokud postižený dýchá obtížně, měl by být podán kyslík.
Pokud postižený nedýchá, provede se resuscitace z úst do úst. Vždy mějte na paměti, že pro osobu poskytující pomoc může být resuscitace z úst do úst nebezpečná, pokud je vdechovaný materiál toxický, infekční nebo žíravý..
Ve všech případech je třeba vyhledat okamžitou lékařskou pomoc (Bezpečnostní list materiálu Chlorid lithný, 2013).
Aplikace
Chlorid lithný je sloučenina používaná k výrobě lithného kovu elektrolýzou. Kov lithia se vyrábí elektrolýzou roztavené směsi chloridů lithia a draslíku.
Nižší teplota tání směsi (400-420 ° C nebo 750-790 ° F) ve srovnání s čistým chloridem lithným (610 ° C nebo 1130 ° F) umožňuje provoz při nižší teplotě elektrolýzy.
Protože napětí, při kterém dochází k rozkladu chloridu lithného, je nižší než napětí chloridu draselného, lithium se ukládá na úrovni čistoty vyšší než 97 procent (Dye, 2017).
Kapalný chlorid lithný slouží jako vysoušedlo, které může snížit hladinu vlhkosti v okolním vzduchu až o 15 procent.
Kapalná vysoušedla, která kombinují chlorid lithný a chlorid vápenatý, vytvářejí látku, která je levnější než chlorid lithný, ale stabilnější než chlorid vápenatý..
Chlorid lithný rychle ochlazuje vzduch, protože chemická látka obsahuje obrovské množství vody vzhledem k její hmotnosti jako pevné látky. Látka také suší velké množství průmyslových plynů.
Chlorid lithný je červené barvivo v pyrotechnických displejích, jako je ohňostroj. Chlorid lithný nebo jakákoli ve vodě rozpustná sůl na bázi lithia hoří po zapnutí červeně.
Speciální pyrotechnické účinky lze zapálit smícháním iontových solí s hořlavými kapalinami, jako je methylalkohol..
Ve 40. letech sloužil chlorid lithný jako náhrada stolní soli, ale někteří pacienti zemřeli na toxické hladiny lithia..
Sloučenina má farmakologické použití jako antimaniaka, což jsou činidla používaná k léčbě bipolárních poruch nebo mánie spojené s jinými afektivními poruchami..
Lidské tělo normálně obsahuje přibližně 7 miligramů lithia v daném okamžiku..
Lithium se přirozeně vyskytuje v rostlinách, protože organismy používají tuto látku ke stimulaci růstu.
Reference
- Dye, J. L. (2017, 23. ledna). Lithium (Li). Obnoveno z britannica: britannica.com.
- EMBL-EBI. (2009, 23. listopadu). chlorid lithný. Obnoveno z ChEBI: ebi.ac.uk.
- Chlorid lithný. (S.F.). Obnoveno z CAMEO: cameochemicals.noaa.gov.
- Bezpečnostní list materiálu Chlorid lithný. (2013, 21. května). Obnoveno z sciencelab.com.
- Národní centrum pro biotechnologické informace… (2005, 26. března). Složená databáze PubChem; CID = 433294. Citováno z PubChem.
- Národní institut pro bezpečnost a ochranu zdraví při práci. (2015, 22. července). Chlorid lithný. Obnoveno z cdc.gov.
- Winter, M. (S.F.). Lithium: chlorid lithný. Obnoveno z webových prvků.



Zatím žádné komentáře