
Vlastnosti, struktura, použití, rizika chloridu manganatého

The chlorid manganatý je anorganická sůl, jejíž chemický vzorec je MnCldva. Skládá se z iontů Mndva+ a Cl- v poměru 1: 2; pro každý kation Mndva+ existuje dvakrát tolik aniontů Cl-.
Tato sůl může tvořit různé hydráty: MnCldva2HdvaO, (dihydrát), MnCldva4HdvaO (tetrahydrát) a MnCldva6HdvaO (hexahydrát) Nejběžnější formou soli je tetrahydrát.

Fyzikální vlastnosti chloridu manganatého, jako je hustota, teplota tání a rozpustnost ve vodě, jsou ovlivněny stupněm hydratace. Například teplota tání bezvodé formy je mnohem vyšší než teplota tání tetrahydrátové formy..
Barva chloridu manganatého je světle růžová (horní obrázek). Bledost je charakteristická pro soli přechodných kovů. Chlorid manganatý je slabá Lewisova kyselina.
Minerál známý jako escacquita je přirozeně bezvodá forma chloridu manganatého; jako kempita.
Jako legující činidlo se používá chlorid manganatý; katalyzátor při chloračních reakcích atd..
Rejstřík článků
- 1 Fyzikální vlastnosti
- 1.1 Fyzický vzhled
- 1,2 molární hmotnosti
- 1.3 Body tání
- 1.4 Bod varu
- 1.5 Hustoty
- 1.6 Rozpustnost ve vodě
- 1.7 Rozpustnost v organických rozpouštědlech
- 1.8 Rozklad
- 1,9 pH
- 1.10 Stabilita
- 2 Struktura chloridu manganatého
- 2.1 Dihydrát
- 2.2 Bezvodý
- 3 Názvosloví
- 4 použití
- 4.1 Laboratoř
- 4.2 Průmysl
- 4.3 Hnojivo a krmivo pro zvířata
- 5 Rizika
- 6 Reference
Fyzikální vlastnosti
Fyzický vzhled
- Bezvodá forma: růžové krychlové krystaly.
- Forma tetrahydrátu: mírně rozplývavé načervenalé monoklinické krystaly.
Molární hmotnosti
- Bezvodý: 125,838 g / mol.
- Dihydrát: 161,874 g / mol.
- Tetrahydrát: 197,91 g / mol.
Body tání
- Bezvodý: 654 ° C.
- Dihydrát: 135 ° C.
- Tetrahydrát: 58 ° C.
Bod varu
Bezvodá forma: 1 190 ° C.
Hustoty
- Bezvodý: 2977 g / cm3.
- Dihydrát: 2,27 g / cm3.
- Tetrahydrát: 2,01 g / cm3.
Rozpustnost ve vodě
Bezvodá forma: 63,4 g / 100 ml při 0 ° C; 73,9 g / 100 ml při 20 ° C; 88,5 g / 100 ml při 40 ° C; a 123,8 g / 100 ml při 100 ° C.
Rozpustnost v organických rozpouštědlech
Rozpustný v pyridinu a ethanolu, nerozpustný v etheru.
Rozklad
Pokud nejsou přijata vhodná opatření, může dehydratace hydratovaných forem na bezvodou formu vést k hydrolytické dehydrataci za vzniku chlorovodíku a oxychloridu manganatého..
pH
0,2 M roztok tetrahydrátu chloridu manganatého ve vodném roztoku má pH 5,5.
Stabilita
Je stabilní, ale citlivý na vlhkost a nekompatibilní se silnými kyselinami, reaktivními kovy a peroxidem vodíku.
Struktura chloridu manganatého

Počínaje tetrahydrátovou solí, s nápadnými růžovými krystaly, musí být složena z koordinačních komplexů (horní obrázek). V nich kovové centrum Mndva+ je obklopen osmistěnem definovaným čtyřmi molekulami HdvaO a dva Cl anionty-.
Všimněte si, že Cl ligandy- jsou v cis polohách; všechny jsou ekvivalentní v obdélníkové základně osmistěnu a nezáleží na tom, zda je Cl „přesunuto“- do kterékoli z ostatních tří pozic. Další možný izomer pro tuto souřadnicovou molekulu je ve kterém oba Cl- jsou v trans pozicích; to znamená v různých extrémech (jeden nahoře a druhý dole).
Čtyři molekuly vody s vodíkovými vazbami umožňují spojení dvou nebo více oktaedrů pomocí dipól-dipólových sil. Tyto mosty jsou vysoce směrové a přidávají elektrostatické interakce mezi Mndva+ a Cl-, vytvořit uspořádanou strukturu charakteristickou pro krystal.
Růžová barva MnCldva4HdvaNebo je to kvůli elektronickým přechodům Mndva+ a jeho konfigurace d5. Podobně narušení způsobená blízkostí molekul vody a chloridů mění množství energie potřebné k absorpci těmito elektrony d5 cestovat po vyšších energetických úrovních.
Dihydrát
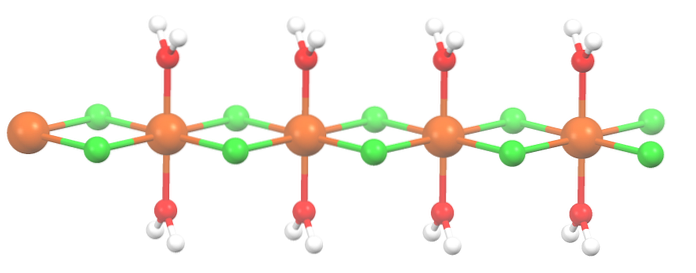
Sůl byla dehydratována a její vzorec je nyní MnCldva2HdvaO. A co osmistěn výše? Nic, kromě dvou molekul HdvaNebo které vypadly, jsou nahrazeny dvěma Cl-.
Nejprve můžete mít mylný dojem, že existují čtyři Cl- pro každý Mndva+; polovina osmistěnu (axiálně) je ve skutečnosti opakující se jednotkou krystalu.
Je tedy pravda, že existuje Mndva+ koordinováno do dvou Cl- a dvě molekuly vody v trans polohách. Aby však tato jednotka mohla komunikovat s jinou, potřebuje dva mosty Cl, což zase umožňuje dokončit koordinační osmistěn pro mangan..
Kromě Cl můstků molekuly vody také spolupracují se svými vodíkovými vazbami, takže tento MnCl řetězecdva2HdvaNebo neozbrojujte.
Bezvodý
Nakonec chlorid hořečnatý dokončil ztrátu veškeré vody obsažené v jeho krystalech; nyní máme bezvodou sůl, MnCldva. Bez molekul vody krystaly znatelně ztrácejí intenzitu svého růžového zabarvení. Oktaedron, pokud jde o hydráty, zůstává nezměněn samotnou povahou manganu.
Bez molekul vody, Mndva+ konce obklopené osmistěnem složeným pouze z Cl-. Tato koordinační vazba má kovalentní i iontový charakter; z tohoto důvodu obvykle odkazuje na strukturu MnCldva jako polymerní krystal. V něm jsou alternativní vrstvy Mn a Cl.
Nomenklatura
Mangan má mnoho možných oxidačních stavů. Z tohoto důvodu je tradiční nomenklatura pro MnCldva není objasněn.
Na druhé straně odpovídá chlorid manganatý jeho známějšímu názvu, ke kterému by bylo nutné přidat „(II)“, aby bylo možné souhlasit s nomenklaturou zásob: chlorid manganatý. Stejně tak existuje systematické názvosloví: chlorid manganatý.
Aplikace
Laboratoř
Chlorid manganatý slouží jako katalyzátor chlorace organických sloučenin.
Průmysl
Chlorid manganatý se používá jako surovina pro výrobu protikusů pro benzín; svařovací materiál pro neželezné kovy; zprostředkovatel při výrobě pigmentů; a sušička lněného oleje.
Používá se v textilním průmyslu pro tisk a barvení; při výrobě různých solí manganu, včetně methylcyklopentadienylmanganu trikarbonylu použitého jako cihlové barvivo; a při výrobě suchých elektrických článků.
Chlorid manganatý se používá jako legovací činidlo a přidává se do roztaveného hořčíku za vzniku slitin manganu a hořčíku; jako meziprodukt při přípravě sušících prostředků na barvy a laky; a jako součást dezinfekčních prostředků.
Používá se také při čištění hořčíku.
Hnojivo a krmivo pro zvířata
Chlorid manganatý se používá jako zdroj manganu, což je prvek, který, i když se nejedná o primární výživný prvek pro rostliny, jako je dusík, fosfor a draslík, se používá v mnoha biochemických reakcích typických pro tyto živé bytosti..
Podobně se přidává do krmiva pro chovná zvířata, aby dodala mangan, základní stopový prvek pro růst zvířat..
Chlorid manganatý je složka stravy, která dodává mangan, prvek, který se účastní mnoha procesů nezbytných pro život, včetně: syntézy mastných kyselin a pohlavních hormonů; asimilace vitaminu E; produkce chrupavky; atd.
Rizika
Při kontaktu s pokožkou může způsobit zarudnutí, podráždění a dermatitidu. Chlorid manganatý způsobuje červené, bolavé a vodnaté oči.
Při vdechování způsobuje sůl kašel, bolest v krku a dušnost. Na druhé straně by požití mohlo způsobit zvracení, nevolnost a průjem..
Chronické nadměrné vdechování této soli může vést k zánětu plic a následnému reaktivnímu onemocnění dýchacích cest..
Jeho nadměrné požití může způsobit duševní poruchy, dehydrataci, hypotenzi, selhání jater a ledvin, selhání multiorgánového systému a smrt..
Neurotoxicita je počátečním projevem nežádoucího účinku manganu a může představovat bolesti hlavy, závratě, ztrátu paměti, hyperreflexii a mírný třes..
Těžká toxicita se projevuje příznaky a příznaky podobnými těm, které se vyskytují u Parkinsonovy choroby.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Chlorid manganatý. Obnoveno z: en.wikipedia.org
- Sky Spring Nanomateriály. (2016). Prášek chloridu manganatého. Obnoveno z: ssnano.com
- Chemická kniha. (2017). Chlorid manganatý. Obnoveno z: chemicalbook.com
- Toxikologická datová síť. (s.f.). Chlorid manganatý. Toxnet. Obnoveno z: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Chlorid manganatý. doi.org/10.1002/047084289X.rm020
- Národní centrum pro biotechnologické informace. (2019). Chlorid manganatý. Databáze PubChem. CID = 24480. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Minerály: mangan. Obnoveno z: webconsultas.com



Zatím žádné komentáře